|
高考化学试题《原电池原理》考点强化练习(2017年押题版)(八)
2018-03-17 08:01:52
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 下列关于实验现象的描述,正确的是______
①由铜锌组成的原电池,电子是从锌经过导线流向铜
②把铜片和锌片紧靠在一起浸入稀硫酸中,铜表面出现气泡
③把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
④把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率加快.
参考答案:①铜锌组成的原电池中,金属锌做负极,金属铜作正极,电子从锌极流向铜极,故①正确;
②把铜片和锌片紧靠在一起浸入稀硫酸中,形成铜、锌、稀硫酸原电池,正极是金属铜,该极上产生气体,故②正确;
③把铜片插入三氯化铁溶液中,铜和氯化铁反应生成氯化铜和氯化亚铁,故③错误;
④把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,形成了铜、锌、稀盐酸原电池,原电池反应可以加速反应的速率,故④正确.
故答案为:①②④.
本题解析:
本题难度:简单
2、填空题 (11分)2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.2F2+2H2O=4HF+O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2
| (4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
参考答案:(1)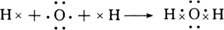 (2分) (2分)
(2)①③ (2分) (3)CD (2分) B(1分)
(4)H2+2OH?—2e?=2H2O (2分) 200NA(2分)
本题解析:(1)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为:
(2)①pH=1的溶液呈酸性,各离子互不反应,可以大量共存;②酸性溶液中,NO3?、H+与Fe2+发生氧化还原反应,不能大量共存;③各离子互不反应,可以大量共存;④HCO3?与H+反应,不能大量共存。
(3)A、2F2+2H2O=4HF+O2, 依据化合价变化,水中O元素化合价升高,水做还原剂;B、2Na2O2+2H2O=4NaOH+O2↑,据化合价变化,此反应是过氧化钠的自身氧化还原反应,水既不是氧化剂也不是还原剂;C、CaH2+2H2O=Ca(OH)2+2H2↑,依据化合价变化,水中的氢元素化合价降低,水做氧化剂;D、3Fe+4H2O(g) Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。 Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。
(4)负极上H2失去电子,电极方程式为:H2+2OH?—2e?=2H2O;H2O的密度约为100g/L,所以1.8 L H2O的物质的量为:1800g÷18g/mol=100mol,根据电池总反应2H2+O2=2H2O可得对应关系:H2O ~ 2e?,所以电子转移为200mol,数目为200NA。
考点:本题考查电子式、离子共存、氧化还原反应原理、原电池原理。
本题难度:一般
3、填空题 用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气______L(标准状况下).导线中通过______mol电子.
参考答案:用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,
锌为负极,电极反应为:Zn-2e-=Zn2+,
铜为正极,电极反应为2H++2e-=H2↑,
锌片的质量减少了3.25克,则物质的量为3.25g65g/mol=0.05mol,
转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,
则:V(H2)=0.05mol×22.4L/mol=1.12L,
故答案为:1.12L;0.1.
本题解析:
本题难度:简单
4、填空题 (1)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下)。导线中通过 mol电子。
(2)H、D、T三种原子,在标准状况下,1 mol各单质中,它们的质子数之比是 ,
(3)含6.02×1023个中子的 Li的质量是 g。 Li的质量是 g。
参考答案:(1) 1.12 L 2分 0、1 mol 2分 (2)1:1:1 2分
(3)1.75 g 3分
本题解析:(1)考查原电池的有关计算。由于锌的金属性强于铜的,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子,电极反应式分别是负极:Zn-2e-=Zn2+、正极:2H++2e-=H2↑。消耗锌是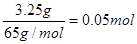 ,转移电子是0.1mol,所以根据电子的得失守恒可知,生成氢气是0.05mol,体积是0.05mol×22.4L/mol=1.12L。 ,转移电子是0.1mol,所以根据电子的得失守恒可知,生成氢气是0.05mol,体积是0.05mol×22.4L/mol=1.12L。
(2)H、D、T三种原子互为同位素,所以质子数是相同的,即单质分子中质子数之比是1
本题难度:一般
5、填空题 理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池(正极材料用碳棒),回答下列问题:
该电池的电解质溶液是 ;负极发生 反应(填“氧化”或“还原”),电极反应式
参考答案:(1)硝酸银 ,氧化反应, Cu -2e-=Cu2+
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可知铜是负极,失去电子,凡是氧化反应,电极反应式是Cu -2e-=Cu2+。银离子在正极得到电子,因此电解质溶液应该是硝酸银溶液。
考点:考查根据原电池的判断和电极反应式的书写
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础性强,侧重考查学生灵活运用原电池原理解决实际问题的能力,有利于提高学生的逻辑推理能力和学习效率。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
|