1、填空题 (I)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:

(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒上产生现象是 ,试用电极反应式表示该现象: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为: 。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为: 。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸
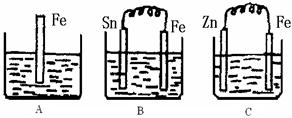
(1)写出A中离子反应方程式:
(2)一段时间后,B中Sn极附近溶液的pH (填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为
(4)反应完成后三个烧杯中液体质量大小顺序为:A B C (用<、=、>连接)。
参考答案:(I)(1)负极(1分)有无色气泡析出(1分) 2H++2e-=H2↑(2分)
(2)还原(1分) Zn-2e-=Zn2+(2分)
(3)1:32(2分)
(II)(1)Fe+2H+=Fe2++H2↑ (2分)
(2)增大 (1分)
(3)0.5mol·L-1(2分)
(4)=、<(每空1分)
本题解析:(I)(1)Zn+CuSO4=ZnSO4+Cu↑
负极:Zn-2e-=Zn2+ 正极:2H++2e-=H2↑
(2)Zn+H2SO4=ZnSO4+H2↑
负极:Zn-2e-=Zn2+ 正极:Cu2++2e-=Cu↑
(3)H2 ~ Zn ~ Cu可知。
(II)B中铁为负极,Sn为正极,2H++2e-=H2↑, pH增大。
C中锌为负极:Zn+H2SO4=ZnSO4+H2↑可求得:
0.25mol 5.6L
c(H2SO4)=0.5mol·L-1
(4)A、B中均发生反应:Fe+H2SO4=FeSO4+H2↑;C中为::Zn+H2SO4=ZnSO4+H2↑
比较可知:A、B硫酸中增加1molFe,析出1molH2,质量增加54g;而C中硫酸中增加1molZn,析出1molH2,质量增加63g;
本题难度:一般
2、填空题 (10分)用下图装置加以必要的导线连接后达到粗铜精炼的目的。
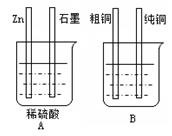
⑴A烧杯是________________(填
参考答案:
本题解析:
本题难度:一般
3、选择题 下列有关燃料电池的说法正确的是
A.氢氧燃料电池可将热能直接转变为电能
B.燃料电池的能量转化率可达100%
C.氢氧燃料电池工作时氢气在负极被氧化
D.以KOH溶液为电解质溶液的氢氧燃料电池,负极反应为O2 + 2H2O + 4e- =4OH-
参考答案:C
本题解析:氢氧燃料电池可将化学能直接转变为电能,不是热能,故A错误;任何电池的能量转化率都不可能达到100%,所以B错误;氢氧燃料电池工作时氢气在负极被氧化,因为氢气转换为水,化合价升高,所以通入氢气的以及为负极,故C正确;D错误,以KOH溶液为电解质溶液的氢氧燃料电池,正极反应为O2 + 2H2O + 4e- =4OH-,是正极不是负极。
点评:本题考查了燃料电池的基础知识,属于高考考查的热点,本题比较容易。
本题难度:一般
4、选择题 X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为
A.M>Z>X>Y
B.X>Y>Z>M
C.X>Z>Y>M
D.X>Z>M>Y
参考答案:C
本题解析:金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出,表明活动性X>Z;若电解Y2+和Z2+离子共存的溶液时,Y先析出,表明活动性Z>Y;M2+离子的氧化性强于Y2+离子,表明活动性Y>M,综述,X>Z>Y>M,C正确。
本题难度:一般
5、选择题 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH+3O2== 2CO2+3H2O,电池示意如下图,下列说法不正确的是
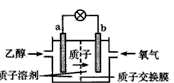
[? ]
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ +O2+4e-==2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
参考答案:D
本题解析:
本题难度:一般