1、选择题 向Fe和Fe2O3的混合物中加入足量的稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为7:1时,Fe和
Fe2O3的物质的量之比为( )
A.1:1
B.1:2
C.2:1
D.3:2
参考答案:设原混合物中含有xmolFe,ymolFe2O3,
Fe2O3+6HCl=2FeCl3+3H2O
y?2y?
2FeCl3+Fe=3FeCl2
2y? y? 3y
? Fe+2HCl=FeCl2+H2↑
(x-y)?(x-y)? (x-y)
则:[3y+(x-y)]:(x-y)=7:1,
y:x=3:2,
故选D.
本题解析:
本题难度:一般
2、选择题 下列化学名词或化学用语正确的是
A.三溴笨酚
B.乙酸的实验式:CH2O
C.梭基
D.氢氧根的电子式: 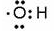
参考答案:B
本题解析:A、苯不是“笨”;B、实验式是最简式,正确;C,该为“羧基”,D该电子式为羟基的。
本题难度:一般
3、填空题 有几种元素的微粒的最外电子层结构如图所示,其中:
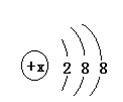
(1)若该微粒呈电中性且一般不和其他元素的原子反应,这种微 粒符号是?。
(2)若该微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊, 这种微粒的电子式是_______。
(3)若该微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是______。
参考答案:(6分)(1)? Ar?(2) ?(3) S2-
?(3) S2-
本题解析:(1)若该微粒呈电中性且一般不和其他元素的原子反应,这种微粒符号是Ar。
(2)若该微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊, 这种微粒是离子,其电子式是 。
。
(3)若该微粒具有还原性,且这种微粒失去2个电子即变为原子,则该原子是S原子,因此这种微粒的符号是S2-。
点评:该题是基础性试题额考查,也是高考的常见题型和重要的考点。该题的关键是记住元素原子的核外电子排布规律,然后灵活运用即可。该题难度不大,学生不难得分。
本题难度:一般
4、选择题 下列反应中属于氧化还原反应的是
A.Cu2(OH)2CO3 2CuO+H2O+CO2↑?
2CuO+H2O+CO2↑?
B.Na2O+H2O = 2NaOH
C.2CO+O2 2CO2
2CO2
D.Na2CO3+CaCl2= CaCO3↓+2NaCl
参考答案:C
本题解析:凡是有元素化合价变化的反应都是氧化还原反应,选项C中碳的化合价升高,氧气中氧元素的化合价降低,所以是氧化还原反应。其余都不是,答案选C。
本题难度:一般
5、选择题 用0.1 mol/L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是
A.+4
B.+3
C.+2
D.+1