1、选择题 以下化学用语正确的是(?)
A.-CH3(甲基)的电子式为
B.乙醇的结构式CH3CH2OH
C.乙烷的结构简式CH3CH3
D.聚丙烯的结构简式: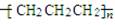
参考答案:C
本题解析:甲基是9电子微粒,电子式为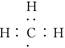 。B中应该是乙醇的结构简式,结构式是指用1根短线表示1对电子对,所以乙醇的结构式为
。B中应该是乙醇的结构简式,结构式是指用1根短线表示1对电子对,所以乙醇的结构式为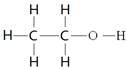 .丙烯甲聚是不苯环碳原子之间的加成,支链不参与,所以结构简式为
.丙烯甲聚是不苯环碳原子之间的加成,支链不参与,所以结构简式为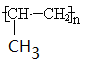 。因此正确的答案是C。
。因此正确的答案是C。
本题难度:一般
2、选择题 下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是
A.CaO + H2O = Ca(OH)2
B.3NO2 + 2H2O = 2HNO3+NO
C.2H2O 2H2↑+O2↑
2H2↑+O2↑
D.2Na +2H2O =2NaOH+H2↑
参考答案:B
本题解析:略
本题难度:简单
3、简答题 为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
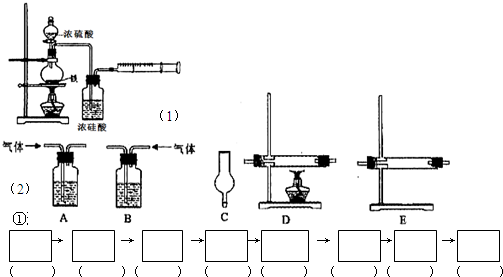
(1)实验目的:分析铁与浓硫酸在加热条件下的反应.
①洗气瓶中浓硫酸的作用是______.
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式______.
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验.
(2)实验目的:检验气体的成分.
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰.
仪器如下图(可重复使用,可根据需要取用);
①连接仪器.将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是______.
(3)实验目的:确定产物的含量.
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有______.
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe3+可采用的试剂为______;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为______mol.
参考答案:(1)①浓硫酸具有吸水性,可用作干燥剂,故答案为:干燥;
②铁在加热条件下发生氧化还原反应生成硫酸铁和二氧化硫气体,反应的化学方程式为2Fe+6H2SO4(浓)?△?.?Fe2(SO4)3+3SO2↑+6H2O,
故答案为:2Fe+6H2SO4(浓)?△?.?Fe2(SO4)3+3SO2↑+6H2O;
(2)①浓硫酸与铁在加热条件下反应生成二氧化硫气体,稀硫酸与铁反应生成氢气,检验二氧化硫气体可用品红溶液,用A装置,然后在A装置中用高锰酸钾溶液(或NaOH溶液)除去二氧化硫气体,再在A中用高锰酸钾酸性溶液(或品红)检验二氧化硫是否除尽,在A或C装置中干燥(用浓硫酸(或碱石灰))后通入D中(氧化铜粉末)吸收氢气,然后在E中用无水硫酸铜固体检验是否有水生成,为防止空气中的水进入E中影响实验结果,应最后连接A或C,
故答案为:A-A-A(或C)-D-E-A(或C)或A-A-A-A(或C)-D-E-A(或C);
品红溶液--高锰酸钾酸性溶液-浓硫酸(或石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸碱石灰,
或:品红溶液-高锰酸钾酸性溶液-高锰酸钾酸性溶液(或品红)-浓硫酸(或碱石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸或碱石灰,或:品红溶液-氢氧化钠溶液-高猛酸钾酸性溶液(或品红)-浓硫酸(或碱石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸或碱石灰;
②若混合气体中含有氢气,D中固体粉末由黑色变为红色,生成铜和水,E中固体由白色变为蓝色,
故答案为:D中固体粉末由黑色变为红色,E中固体由白色变为蓝色;
(3)①测定混合气体中各成分含量,应知道气体的总量和某一种气体的量,氢气的量可根据反应前D中氧化铜粉末质量反应后D中粉末的质量计算,
故答案为:混合气体的总体积;反应前后D中粉末质量的差值(反应前D中氧化铜粉末质量反应后D中粉末的质量);
②检验Fe3+可用KSCN溶液,n(Fe)=11.2g56g/mol=0.2mol,
则n(Fe2+)+n(Fe3+)=0.2mol,由2Fe2++Cl2=2Fe3++2Cl-,可知n(Fe2+)=2n(Cl2)=2×1.12L22.4L/mol=0.1mol,
则n(Fe3+)=0.1mol,
故答案为:KSCN溶液;0.1.
本题解析:
本题难度:一般
4、选择题 下图是利用钛白粉生产海绵钛(Ti)的一种工艺流程:

有关说法正确的是(?)
A.反应Ⅰ中钛白粉(TiO2)做氧化剂
B.该工艺中可以循环使用的物质只有Cl2
C.可以用N2代替Ar作为反应Ⅱ中的保护气
D.反应Ⅱ的化学方程式为2Mg+TiCl4 2MgCl2+Ti
2MgCl2+Ti
参考答案:D
本题解析:A项,反应Ⅰ中TiO2转化为TiCl4,Ti的化合价不变,TiO2既不是氧化剂又不是还原剂;B项,该工艺中可以循环使用的物质有Mg、Cl2;C项,Mg能与N2反应,N2不能作为反应Ⅱ中保护气;D项,反应Ⅱ为Mg和TiCl4的置换反应。
点拨:本题考查海绵钛生产流程,考查考生对化工流程的综合分析能力。难度中等。
本题难度:一般
5、选择题 下列实验均发生化学反应:①将铁钉放人CuSO4溶液中;②FeSO4溶液中滴加浓HNO3;③将铜丝放入FeCl3溶液中。下列判断中,正确的是( )
A.上述实验证明了氧化性:
B.上述实验证明了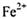 既有氧化性又有还原性
既有氧化性又有还原性
C.实验①、③中的化学反应都是置换反应
D.向三个实验后的溶液巾加人足量NaOH溶液,最终邰冇Fe(OH)3生成
参考答案:D
本题解析:①发生置换反应,能证明铜离子的氧化性强于二价铁离子,A错。②发生氧化还原反应,证明氧化性硝酸强于三价铁离子。③铜与氯化铁反应生成氯化铜和氯化亚铁,能证明氧化性三价铁离子强于铜离子。综合考虑,三个反应中没有二价铁表现还原性的反应,B错,C 错。氢氧化亚铁很容易被空气氧化生成氢氧化铁,所以最终都有氢氧化铁生成
本题难度:一般