| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《有关氧化还原反应的计算》在线测试(2017年最新版)(十)
参考答案:D 本题解析:A.1 molCu2S参加反应时有1mol×2×(2-1)+1mol×[6-(-2)]=10mol电子转移,故A错误;B.由2Cu2S+14HNO3=2Cu(NO3)2+2CuSO4+5NO2↑+5N0↑+7H2O可知,参加反应的n(Cu2S):n(HNO3)=2:14,故B错误;C.Cu、S元素的化合价升高,Cu2S做还原剂,故C错误;D.由发生的反应可知,产物n[Cu(NO3)2]:n[CuSO4]=1:1,故D正确;故选D。 本题难度:一般 2、简答题 常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室.左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的
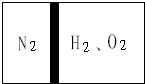 参考答案:设氮气的物质的量为1mol, 本题解析: 本题难度:一般 3、选择题 下列有关化学用语使用正确的是(?) 参考答案:B 本题解析:A.在二氧化碳分子中每个碳原子与两个原子形成四对共用电子对。错误。B氧原子与氢原子、氯原子形成两对共用电子对。正确。C.氯是17号元素,原子核内有17个质子,跟中子数无关。错误。D.二氧化硅是原子晶体,硅原子核氧原子个数比为:1:2.错误。 本题难度:一般 4、选择题 下列变化须加入还原剂才能实现的是? 参考答案:B 本题解析:需要加入还原剂才能实现的反应是还原反应,从化合价上表现的是价态降低。答案选B。 本题难度:一般 5、选择题 已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
A.混合后,甲、乙溶液中溶质的质量分数均大于5% B.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5% C.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5% D.混合后,甲、乙溶液中溶质的质量分数均等于5% 参考答案:B 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《金属的腐蚀.. | |