1、选择题 下列叙述正确的是
[? ]
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol 电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
参考答案:C
本题解析:
本题难度:一般
2、选择题 用石墨作电极,电解硫酸铜和氯化钠的混合溶液,在溶液中2n(Na+)≤n(SO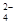 ),在任何情况下,阴、阳两极不可能同时发生的反应是? ( )
),在任何情况下,阴、阳两极不可能同时发生的反应是? ( )
参考答案:B
本题解析:根据离子的放电酸性可知,阳极是氯离子放电,然后是OH-放电。阴极是铜离子放电,然后是氢离子放电。由于溶液中2n(Na+)≤n(SO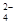 ),所以根据电荷守恒可知,溶液中2n(Cl-)≤n(Cu2+),因此再氯离子放电的同时,阴极一定是铜离子放电,即选项B是错误的,答案选B。
),所以根据电荷守恒可知,溶液中2n(Cl-)≤n(Cu2+),因此再氯离子放电的同时,阴极一定是铜离子放电,即选项B是错误的,答案选B。
本题难度:一般
3、选择题 以Pt为电极,电解含有0.10mol M+和0.10mol N3+ (M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如下图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)
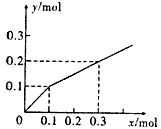
[? ]
A.M+ > H+ > N3+
B.M+ >N3+ > H+
C.N3+ >H+ > M+
D.条件不足,无法确定
参考答案:A
本题解析:
本题难度:一般
4、填空题 按要求对下图中两极进行必要的连接并填空
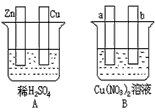
(1)在A图中,使铜片上冒H2气泡。请加以必要连接____________________,则连接后的装置叫____________。电极反应式:锌板: _______________;铜板: ___________
(2)在B图中,(a和b均为惰性电极)使a极析出铜,请加以必要的连接后,该装置叫______________。电极反应式,a极:_________________;b极:________________。在经过一段时间后,停止反应并搅均溶液,溶液的pH____________(升高、降低、不变),加入一定量的_______________后,溶液能恢复至与电解前完全一致。
参考答案:(1)联接画线“略”;原电池;锌板:Zn-2e-=Zn2+;铜板:2H++2e-=H2↑
(2)电解池;a极:Cu2++2e-==Cu;b极:4OH--4e-=O2↑+2H2O;降低;CuO
本题解析:
本题难度:一般
5、计算题 以石墨为电极,电解1L硫酸铜和氯化钠的混合溶液,其中硫酸铜与氯化钠的物质的量之和为0.2mol,硫酸铜的物质的量占总物质的量的比值为x。
(1)若x=0.5,当Cu2+在阴极恰好全部析出时,阳极产生的气体是什么?其物质的量是多少?所得溶液的pH是多少?
⑵电解一段时间后,阴、阳两极产生气体的物质的量恰好相等,均为0.16mol,求此时x的值
参考答案:Cl2? 0.05mol? O2? 0.025 mol? 1? 0.6
本题解析:(1)若x=0.5,则硫酸铜是0.1mol,氯化钠是0.1mol。阴极首先是铜离子放电,Cu2++2e-=Cu,所以当铜离子放电完毕之后,转移的电子是0.2mol。在阳极上先是氯离子放电,2Cl--2e-=Cl2↑。氯化钠是0.1mol,生成氯气0.05mol,转移电子是0.1mol,所以根据得失电子守恒可知,在阳极上还有氧气生成。因为4OH--4e-=2H2O+O2↑,所以氧气是
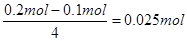 。则同时产生的氢离子是0.1mol,浓度为0.1mol/L,pH是1.
。则同时产生的氢离子是0.1mol,浓度为0.1mol/L,pH是1.
(2)阴、阳两极均产生气体,说明在阴极上当铜离子放电完毕之后,溶液中的氢离子开始放电,2H++2e-=H2↑,氢气是0.16mol,得到电子0.32mol。原混合液中氯化钠最多是0.2mol,即氯离子最多失去0.2mol电子,所以阳极一定还有氧气生成。硫酸铜是0.2xmol,需要得到电子0.4xmol。氯化钠是0.2(1-x)mol。生成氯气是0.1(1-x)mol,则氧气的物质的量是0.16mol-0.1(1-x)mol=(0.06mol+0.1xmol)。根据得失电子守恒可知0.32mol+0.4xmol=0.2(1-x)mol+4×(0.06mol+0.1xmol),解得x=0.6.
本题难度:一般