| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《电解池原理》高频试题预测(2017年最新版)(十)
参考答案:D 本题解析:A、锌比铜活泼,所以铜锌原电池中铜是正极,正确;B、用电解法精炼铜时粗铜作阳极,发生氧化反应,纯铜作阴极,发生还原反应得到单质铜,正确;C、电镀时,镀层金属作阳极,镀件作阴极,所以在镀件上镀铜时可用铜作阳极,正确;D、电解稀硫酸溶液制H2、O2时,若铜做阳极,则在阳极放电的是活性电极Cu,不是氢氧根离子,所以得不到氧气,错误,答案选D。 本题难度:一般 3、选择题 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是 |
参考答案:A
本题解析:溶液中的阳离子的放电能力:Cu2+>H+>Na+;溶液中的阴离子的放电能力:Cl->OH->SO42-。A.在电解过程中,阳极首先发生反应:2Cl—-2e-=Cl2↑;当Cl—放电完全,发生反应:4OH—-4e-=O2↑+2H2O,所以整个过程中阳极先产生Cl2,后产生O2,正确;B.阳极产物首先是Cl2,然后是O2;在阴极产物首先是Cu,然后是H2;错误;C.BC段表示在阴极上是Cu2+放电,在阳极是c(OH-)放电产生了O2,溶液的c(H+)浓度增大,错误;D.在CD段溶液的pH降低是由于在阳极上是OH-放电产生O2,在阴极是c(H+)放电,实质是电解水,使溶液的c(H+)增大,所以溶液的酸性进一步增强,错误。
考点:考查电解原理的应用的知识。
本题难度:一般
4、填空题 (14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S (n—1)S+ S2-
S (n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题20图—2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
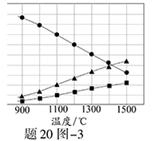
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H2S在高温下分解反应的化学方程式为 。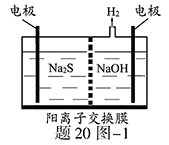

参考答案:
(1)① 2H2O+2e-=H2↑+2OH-
② Sn2-+2H+="(n-1)S↓+" H2 S↑
(2)①Cu、Cl ②0.5mol ③提高空气的比例(增加氧气的通入量)
(3)2H2S 2H2+S2
2H2+S2
本题解析:(1)阴极是水产生的氢离子放电;电解后生成Sn2-,与酸发生歧化反应反应生成硫单质和硫化氢;(2)根据电子守恒,硫化氢电子给了氧气,氧气得电子为0.5mol;增加铁离子含量,使硫化铜被充分氧化,所以需增加氧气使亚铁离子被充分氧化;(3)由图判断生成两种气体体积比为2:1,只能产生S2才符合题意。
考点:本题考查常见离子的大量共存问题。
本题难度:一般
5、填空题 (13分)按下图装置进行实验,并回答下列问题。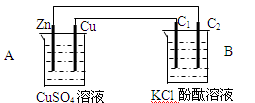
(1)判断装置的名称:A池为___________B池为______________
(2)锌极电极反应式为_________________________
石墨棒C1电极反应式为________________________
石墨棒C2附近发生的实验现象为______________________________
(3)当C2极析出224mL气体(标准状况)时,CuSO4溶液的质量增加_________g。
参考答案:(13分)(1)原电池;电解池
(2)Zn-2e-=Zn2+; 2Cl--2e-= Cl2; C2上有气泡产生且其周围溶液颜色由无色变为浅红(或变为红色,两个现象各1分,意思对即给分)
(3)0.01(3分)
本题解析:(1)A中存在Zn与硫酸铜的反应,所以A为原电池,则B为电解池;
(2)A中Zn比Cu活泼,所以Zn做原电池的负极,发生氧化反应,失去电子生成锌离子,则电极反应式为Zn-2e-=Zn2+;石墨C1与原电池的正极相连,则石墨C1为阳极,发生氧化反应,氯离子失去电子生成氯气,电极反应式为2Cl--2e-= Cl2;则石墨C2为阴极,发生还原反应,氢离子得到电子生成氢气,则氢氧根离子的浓度增大,所以石墨C2附近有气泡产生且溶液变红色;
(3)当C2极析出224mL气体(标准状况)时,即产生0.224L/22.4L/mol=0.01mol氢气时,转移电子的物质的量是0.02mol,A中每转移2mol电子,有65g锌离子进入溶液,则有64gCu析出,溶液质量增加1g,CuSO4溶液的质量增加,所以转移0.02mol电子时,硫酸铜溶液的质量增加0.01g。
考点:考查电化学反应原理的判断
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《有关氧化还.. | |