1、选择题 下列叙述正确的是
[? ]
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.能与酸反应的氧化物,一定是碱性氧化物
D.核外电子总数相同的原子,一定是同种元素的原子
参考答案:D
本题解析:
本题难度:简单
2、选择题 几种短周期元素的原子半径及主要化合价见下表,下列叙述正确的是
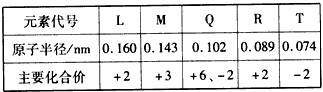
[? ]
A.Q、T两元素的氢化物的沸点为HnT<HnQ
B.L、R的单质与盐酸反应的速率R>L
C.M与T形成的化合物有两性
D.L、Q形成的简单离子核外电子数相等
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列有关短周期元素的叙述中,肯定正确的是( )
A.原子最外层电子只有1个或2个的元素是金属元素
B.16号元素原子的最外层电子数是4号元素原子最外层电子数的四倍
C.11号元素与17号元素能形成XY2型化合物
D.136C表示的碳原子核内有6个质子、7个中子
参考答案:A.原子最外层电子只有1个或2个的元素不一定为金属元素,如H、He,故A错误;
B.16号元素原子的最外层电子数为6,4号元素原子最外层电子数为2,则16号元素原子的最外层电子数是4号元素原子最外层电子数的三倍,故B错误;
C.11号元素与17号元素能形成XY型化合物,故C错误;
D.136C表示的碳原子核内有6个质子,中子为13-6=7,故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 X为主族元素,其原子最外层只有一个电子,Y元素的最高正价与负价的代数和为0,Z元素原子的最外层电子数是次外层的3倍,则X、Y、Z形成的化合物的化学式不可能是
[? ]
A.X2Z2?
B.X4YZ4
C.X2Y2Z4?
D.X5Y2
参考答案:D
本题解析:
本题难度:简单
5、填空题 (9分)下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ④
| ⑤
| ⑥
| ?
| ?
|
②
| ?
| ?
| ③
| ?
| ?
| ?
| ⑦
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| Fe
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

(1)若E为氧化物,则A与水反应的化学方程式为?,①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为?
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为?
(2)若E为单质气体,D为白色沉淀,A的化学式可能是?
参考答案:(9分)(1) 3NO2 +H2O=2HNO3 + NO?①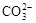 +H2O
+H2O  ?
? +OH-
+OH-
② Fe + 4H+ + =Fe3+ + NO↑+2H2O?(2)Na 、Na2O2或NaH;(3分)
=Fe3+ + NO↑+2H2O?(2)Na 、Na2O2或NaH;(3分)
(除注明外每空2分)
本题解析:(1)若E为氧化物,则常温下能和水反应生成氧化物的物质只有NO2,所以A是NO2,E是NO,B是硝酸,反应的化学方程式是3NO2 +H2O=2HNO3 + NO。根据转化可知,当X是碱性盐溶液,C分子中有22个电子,则C是CO2,所以X是碳酸盐,则D是碳酸氢盐,所以反应的方程式是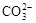 +H2O
+H2O  ?
? +OH-;当X为金属单质时,X一定是变价的金属,所以X是铁,则C是硝酸铁,D是硝酸亚铁。反应的离子方程式是Fe + 4H+ +
+OH-;当X为金属单质时,X一定是变价的金属,所以X是铁,则C是硝酸铁,D是硝酸亚铁。反应的离子方程式是Fe + 4H+ + =Fe3+ + NO↑+2H2O。
=Fe3+ + NO↑+2H2O。
(2)(2)若E为单质气体,D为白色沉淀,所以符合条件的应该是钠或过氧化钠或NaH。此时E是氧气,B是氢氧化钠X是氯化铝,C是偏氯酸钠,D是氢氧化铝。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般