1、选择题 BaCl2剧毒,致死量为0.3g,万一不慎误服,应大量吞服鸡蛋清及适量解毒剂,此解毒剂应是
A.AgNO3
B.CuSO4
C.Na2CO3
D.MgSO4
参考答案:D
本题解析:分析:氯化钡有毒,实际上是钡离子有毒,只有把可溶的氯化钡变成不溶性的钡盐,才不会在体内形成钡离子.
解答:A、氯化钡与硝酸银反应,生成不溶的氯化银,但生成的硝酸钡仍能电离出钡离子,且银离子属于重金属离子,不能达到目的,故A不正确.
B、硫酸铜能与氯化钡反应生成硫酸钡沉淀和氯化铜,铜离子属于重金属有毒离子,故B不正确;
C、氯化钡与碳酸钠反应生成了不溶的碳酸钡,但在胃中又会和胃酸作用重新生成氯化钡,不能解毒,故C不正确;
D、氯化钡和硫酸镁反应生成不溶的硫酸钡,不会再形成钡离子,而少量镁离子不影响健康,故D正确;
故选D.
点评:本题是考查复分解反应,要掌握复分解反应的条件和盐类物质的溶解性,才能解答该问题.
本题难度:困难
2、选择题 下列叙述中正确的是
A.阳离子一定含有金属元素, 阴离子一定只含有非金属元素
B.某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物
C.阴阳离子相互作用后一定形成离子化合物
D.金属钾不可能从盐的水溶液中置换出金属单质
参考答案:D
本题解析:略
本题难度:简单
3、选择题 从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.Cl2溶于水
B.碘升华
C.氯化钠受热熔化
D.酒精溶解于水
参考答案:A、氯气溶于水发生了化学反应,氯气和水反应生成盐酸和次氯酸,所以既有旧化学键的断裂,又有新化学键的形成,故A正确.
B、碘升华是物理变化,只是物质的状态发生了变化,没有发生化学反应,所以没有旧化学键的断裂和新化学键的形成,故B错误.
C、氯化钠受热熔化是物理变化,只是物质的状态发生了变化,没有发生化学反应,故C错误.
D、酒精溶于水没有发生化学反应,所以没有旧化学键的断裂和新化学键的形成,故D错误.
故选A.
本题解析:
本题难度:简单
4、填空题 (共14分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应
| 平衡常数
| 温度(℃)
|
500
| 800
|
①2H2(g)+CO(g) CH3OH(g) CH3OH(g)
| K1
| 2.5
| 0.15
|
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g)
| K2
| 1.0
| 2.50
|
③3H2(g)+ CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g)
| K3
|
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。

(3)判断反应③△H 0; △S 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆)(填“>”“=”或“<”)
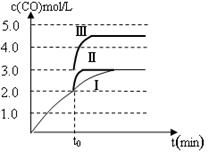
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,
将0.2 mol/L的乙酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为
参考答案:(共14分)
(1)吸热(1分)
(2)=(1分)
(3)< 、<(各2分);>(2分)
(4)加入催化剂(2分);
将容器的体积快速压缩至2L(2分,只写出加压或缩小容器体积得1分)
(5) c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+)(2分)
本题解析:(1)对于反应②,温度升高,平衡常数增大,说明升高温度对正反应有利,所以该反应是吸热反应;
(2)平衡常数是温度常数,只随温度变化,所以A、B点的温度相同,平衡常数也相同,K(A)=K(B)
(3)反应③=反应①+反应②,所以K3=K1·K2,500℃K3=2.5,800℃ K3=0.375,温度升高,平衡常数减小,说明温度升高对逆反应有利,正向是放热反应,所以△H<0,由化学方程式的系数可知,反应物中气体的总系数是4,生成物的总系数是2,所以△S<0;
(4)t0时刻曲线Ⅰ变为曲线Ⅱ时,CO的浓度未变,到达平衡的时间缩短,说明反应速率加快,平衡不移动,所以改变的条件是加入催化剂;曲线Ⅰ变为曲线Ⅲ时,CO的浓度由2.0mol/L增大到3.0mol/L,浓度增大1.5倍,说明容器的体积由原来的3L迅速缩小1.5倍,变为2L,达平衡时CO的浓度是4.5mol/L,所以改变的条件只能是将容器的体积快速压缩至2L;
(5)0.2 mol/L的乙酸与0.1 mol/LBa(OH)2溶液等体积混合,醋酸与氢氧化钡恰好完全反应,生成醋酸钡溶液,尽管醋酸根离子水解,但醋酸根离子浓度仍大于钡离子浓度,水解使溶液显碱性,所以离子浓度的大小关系是c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+)。
考点:考查化学热效应的判断,化学平衡常数的应用,图像的分析,溶液的离子浓度的比较
本题难度:困难
5、选择题 已知H2(g)+Br2(1)=2HBr(g) △H=-72 kJ·mol-1,蒸发1 mol Br2 (1)需要吸收的能量为30 kJ,其他的相关数据如下表: 则表中a为

[? ]
A. 404
B. 260
C. 230
D. 200
参考答案:D
本题解析:
本题难度:一般