1、填空题 (10分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) 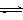 CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1
①该反应能否自发进行与__________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是__________(填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
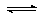 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所
需时间/min
|
H2O
| CO
| H2
| CO
|
1
| 650
| 2
| 4
| 1.6
| 2.4
| 5
|
2
| 900
| 1
| 2
| 0.4
| 1.6
| 3
|
3
| 900
| a
| b
| c
| d
| t
|
①实验1中以v(CO2) 表示的反应速率为__________。
②该反应的逆反应为 __________(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)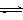 CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ?mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ?mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
参考答案:(1)①温度(2分) ②bc(2分)
(2)① 0.16mol·L-1·min-1 (2分) ②吸(2分)
(3)cd(2分)
本题解析:略
本题难度:困难
2、填空题 (6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
参考答案:(6分)(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O (g); △H="-641.63" KJ/mol(2)408.815
本题解析:(1)0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出256.652kJ/0.4=641.63KJ的热量,所以N2H4(l)+2H2O2(l)=N2(g)+4H2O (g); △H="-641.63" KJ/mol;(2)16g液态肼的物质的量为0.5mol,生成液态水时放出的热量为641.63 KJ/mol×0.5mol+44kJ/mol×2mol=408.815kJ。
考点:热化学方程式及反应热的计算
本题难度:一般
3、填空题 (5分)在HF、H2O、NH3、CH4、CO32-、CO2、HI分子中
(1)CO32-的价层电子对的空间构型为?
(2)以极性键相结合,具有正四面体结构的非极性分子是?。
(3)以极性键相结合,具有三角锥型结构的极性分子是?。
(4)以极性键相结合,具有V型结构的极性分子是?。
(5)以极性键相结合,而且分子极性最大的是?。
参考答案:(1)平面三角型?(2)CH4?(3)NH3?(4)H2O?(5)HF
本题解析:(1)CO32-的价层电子对的空间构型为平面三角型;(2)以极性键相结合,具有正四面体结构的非极性分子是CH4分子;(3)以极性键相结合,具有三角锥型结构的极性分子是NH3分子;(4)以极性键相结合,具有V型结构的极性分子是H2O分子;(5)以极性键相结合,而且分子极性最大的是HF分子,
本题难度:一般
4、选择题 下列变化中,必须加入还原剂才能实现的是
A.MnO2→Mn2+
B.Zn→Zn2+
C.H2→H2O
D.CuO→CuCl2
参考答案:A
本题解析:分析:必须加入还原剂才能实现氧化还原反应,说明该物质作氧化剂,得电子化合价降低,据此分析解答.
解答:A、MnO2→Mn2+中锰元素得电子化合价降低,所以二氧化锰作氧化剂,必须加入还原剂才能实现,故A正确.
B、Zn→Zn2+中锌失电子化合价升高,所以锌作还原剂,必须加入氧化剂才能实现,故B错误.
C、H2→H2O中氢元素失电子化合价升高,所以氢气作还原剂,必须加入氧化剂才能实现,故C错误.
D、CuO→CuCl2中铜元素化合价不变,所以不是氧化还原反应,故D错误.
故选A.
点评:本题考查氧化还原反应,明确元素的化合价降低时物质被还原、元素的化合价升高时被氧化是解答本题的关键,难度不大.
本题难度:简单
5、选择题 参照反应Br + H2 HBr +H的能量对反应历程的示意图(如右图),下列叙述中正确的
HBr +H的能量对反应历程的示意图(如右图),下列叙述中正确的
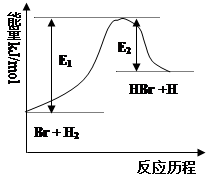
A.正反应为放热反应
B.正反应为吸热反应
C.加入催化剂,活化能改变引起反应热也改变
D.加入催化剂,正反应速率增大、逆反应速率减小