1、选择题 下列关于电解质溶液的叙述正确的是
A.常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中c(NH4+) ①<②<③
B.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
参考答案:D
本题解析:磷酸氢铵能电离出氢离子,抑制NH4+水解,碳酸铵中CO32-水解促进NH4+水解,所以c(NH4+)应该是①<③<②,A不正确;硫酸铵水解促进水的电离,B不正确;醋酸是弱酸,在pH相等的条件小,醋酸的浓度大,消耗的氢氧化钠多,C不正确;硫化钠的水解程度大于NaHS的水解程度,所以D正确,答案选D。
本题难度:简单
2、选择题 有常温下物质的量浓度均为0.1 mol/L的①氨水②NH4Cl溶液③Na2CO3溶液?④NaHCO3溶液,下列说法正确的是(?)
A.4种溶液pH的大小顺序:①>④>③>②
B.等体积的①和②溶液混合后若pH>7:c(Cl-)>c(N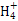 )
)
C.溶液①、③由水电离产生的c(OH-):①<③
D.溶液③、④等体积混合后,溶液中c(C )>c(HC
)>c(HC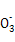 )
)
参考答案:C
本题解析:Na2CO3水解程度大于NaHCO3,碱性强,故4种溶液pH的大小顺序:①>③>④>②,A错;根据溶液电中性:c(N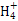 )+c(H+)=c(Cl-)+c(OH-),由溶液的pH>7,可知c(H+)<c(OH-),故c(N
)+c(H+)=c(Cl-)+c(OH-),由溶液的pH>7,可知c(H+)<c(OH-),故c(N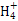 )>c(Cl-),B错;Na2CO3水解促进水的电离,NH3·H2O电离抑制水的电离,故水电离产生的c(OH-):①<③,C对;③、④等体积混合后以C
)>c(Cl-),B错;Na2CO3水解促进水的电离,NH3·H2O电离抑制水的电离,故水电离产生的c(OH-):①<③,C对;③、④等体积混合后以C 的水解为主,且C
的水解为主,且C 水解生成HC
水解生成HC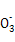 ,故溶液③、④等体积混合后,溶液中c(C
,故溶液③、④等体积混合后,溶液中c(C )<c(HC
)<c(HC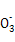 ),D错。
),D错。
本题难度:一般
3、选择题 关于pH相同的醋酸和盐酸,下列叙述正确的是
A.取等体积的醋酸和盐酸,分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m<n
B.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸
C.取等体积的两种酸,分别用完全一样的NaOH溶液进行中和,醋酸消耗NaOH的物质的量比盐酸消耗的多
D.两种酸中c (CH3COO-) > c (Cl-)
参考答案:C
本题解析:盐酸是强酸,醋酸是弱酸,醋酸溶液中存在电离平衡,加水稀释能促进弱电解质电离,pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,不同的酸和相同金属反应,生成氢气的速率与溶液中离子浓度成正比;A、pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,促进醋酸的电离,结果两溶液的pH仍然相同,所以醋酸稀释的倍数大,即m>n,错误;B、pH相同的醋酸和盐酸氢离子浓度相同,所以取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸等于醋酸,错误;C、pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸消耗NaOH的物质的量比盐酸多,正确;D、pH相同的醋酸和盐酸氢离子浓度相同,则氢氧根离子浓度也相同,根据电荷守恒知c(CH3COO-)=c(Cl-),错误。
本题难度:一般
4、选择题 下列物质的水溶液能够导电,但属于非电解质的是
A.醋酸
B.甲烷
C.二氧化硫
D.氯气
参考答案:C
本题解析:溶于水或熔融状态下能导电的化合物是电解质,溶于水和熔融状态下能不能导电的化合物是非电解质。所以A是电解质,B是非电解质。氯气是单质,既不是电解质,也不是非电解质。SO2溶于水生成亚硫酸,溶液可以导电,但SO2是非电解质。答案选C。
本题难度:一般
5、填空题 (6分)下列物质:①水②醋酸③盐酸④烧碱⑤硝酸钾⑥酒精⑦汽油⑧蔗糖
(用编号回答)其中属于弱电解质的有 ;属于强电解质的有 ;强电解质在水中 电离。
参考答案:①②;④⑤;完全(几乎完全;全部)
本题解析:略
本题难度:简单