1、选择题 下列溶液中,Na+浓度最大的是(? )
A.0.8 L 0.4 mol·L-1的NaOH
B.0.2 L 0.15 mol·L-1的Na3PO4
C.1 L 0.3 mol·L-1的NaCl
D.4 L 0.5 mol·L-1的NaCl
2、填空题 (1)完成下列基本计算:
①3.6 g H2O的物质的量为 mol;
②分子数为3.01×1023的H2的物质的量为 mol;
③标准状况下,8.96 L N2的物质的量为 mol;
④75 mL 2.0 mol·L-1 CaCl2溶液中含CaCl2 mol。
(2)选出下列各小题物质分离或提纯所依据的物理性质和分离方法。
| 性质差异
| 分离方法
|
①除去氯化钠溶液中的泥沙
|
|
|
②用四氯化碳提取溴水中的溴单质
|
|
|
③分离乙酸(沸点1180C)与乙酸乙酯(沸点77.10C)
|
|
|
④分离汽油和水
|
|
|
⑤从含有少量NaCl的KNO3溶液中提取KNO3
|
|
|
性质差异:A、溶解度随温度变化差异 B、在不同溶剂中的溶解度差异
C、沸点差异 D、互不相溶 E、在水中的溶解度差异
分离方法:a、蒸馏 b、过滤 c、分液 d、萃取 e、结晶
(3)工业电解食盐水制取氯气的化学方程式: 。
3、选择题 根据有关信息:2SO2(g)+O2(g)?2SO3(g)+196.7KJ;某种硝酸钙晶体可表示为Ca(NO3)2·8H2O;25℃时NaHCO3的溶解度为9.6g/100g水;空气中氧气的体积分数为21%,判断下列有关数据正确的是
A.室温下,配制2.5mol/L的NaHCO3溶液
B.爆炸最强烈的坑道气中甲烷的体积分数为10.5%
C.用1molSO2气体与足量氧气反应放出的热量为98.35KJ
D.与CaO作用直接制Ca(NO3)2·8H2O所用硝酸的质量分数为50%
4、选择题 向100 mL BaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的总物质的量和加入混合溶液B的体积关系如图所示:
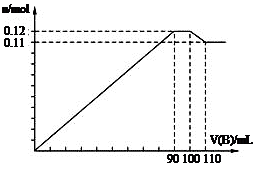
(1)当加入B溶液110 mL时,溶液中的沉淀是?。(填化学式)
(2)从90 mL至100 mL之间加入10 mLB溶液时,由图像纵坐标不变可知此段发生反应的离子方程式是:①?;②?;并由此可以分析出溶液B中Na2SO4与NaOH物质的量浓度之比为?。?
(3)通过计算分析可知:
B溶液中NaOH物质的量浓度为?mol/L;
A溶液中FeCl3物质的量浓度为?mol/L。
5、选择题 相同物质的量的N2和CO两者相比较,下列叙述中不正确的是
A.所含分子数相等
B.所含原子总数相等
C.所含电子总数相等
D.所占的体积一定相等