1、选择题 下列溶液中,Na+浓度最大的是(? )
A.0.8 L 0.4 mol·L-1的NaOH
B.0.2 L 0.15 mol·L-1的Na3PO4
C.1 L 0.3 mol·L-1的NaCl
D.4 L 0.5 mol·L-1的NaCl
参考答案:D
本题解析:比较c(Na+),只看溶液的浓度就可以,不必看体积大小。
本题难度:简单
2、填空题 (1)完成下列基本计算:
①3.6 g H2O的物质的量为 mol;
②分子数为3.01×1023的H2的物质的量为 mol;
③标准状况下,8.96 L N2的物质的量为 mol;
④75 mL 2.0 mol·L-1 CaCl2溶液中含CaCl2 mol。
(2)选出下列各小题物质分离或提纯所依据的物理性质和分离方法。
| 性质差异
| 分离方法
|
①除去氯化钠溶液中的泥沙
|
|
|
②用四氯化碳提取溴水中的溴单质
|
|
|
③分离乙酸(沸点1180C)与乙酸乙酯(沸点77.10C)
|
|
|
④分离汽油和水
|
|
|
⑤从含有少量NaCl的KNO3溶液中提取KNO3
|
|
|
性质差异:A、溶解度随温度变化差异 B、在不同溶剂中的溶解度差异
C、沸点差异 D、互不相溶 E、在水中的溶解度差异
分离方法:a、蒸馏 b、过滤 c、分液 d、萃取 e、结晶
(3)工业电解食盐水制取氯气的化学方程式: 。
参考答案:(1)①0.2; ②0.5; ③0.4; ④0.15。
w.w.^w.k.&s.5*u.c.#om高.考.资.源.网 (2)
性质差异
分离方法
①除去氯化钠溶液中的泥沙
E
b
②用四氯化碳提取溴水中的溴单质
B
d(或dc)
③分离乙酸(沸点1180C)与乙酸乙酯(沸点77.10C)
C
a
④分离汽油和水
D
c
⑤从含有少量NaCl的KNO3溶液中提取KNO3
A
e
 (3)2NaCl + 2H2O 2NaOH+H2↑ + Cl2↑
(3)2NaCl + 2H2O 2NaOH+H2↑ + Cl2↑
本题解析:略
本题难度:一般
3、选择题 根据有关信息:2SO2(g)+O2(g)?2SO3(g)+196.7KJ;某种硝酸钙晶体可表示为Ca(NO3)2·8H2O;25℃时NaHCO3的溶解度为9.6g/100g水;空气中氧气的体积分数为21%,判断下列有关数据正确的是
A.室温下,配制2.5mol/L的NaHCO3溶液
B.爆炸最强烈的坑道气中甲烷的体积分数为10.5%
C.用1molSO2气体与足量氧气反应放出的热量为98.35KJ
D.与CaO作用直接制Ca(NO3)2·8H2O所用硝酸的质量分数为50%
参考答案:
D
本题解析:
本题综合考查常规计算。25℃时NaHCO3的溶解度为9.6g/100g水,所以饱和NaHCO3溶液的物质的量浓度约为1mol/L,所以无法配制2.5mol/L的NaHCO3溶液,A选项错误;爆炸最强烈的情况是甲烷与氧气完全反应,设甲烷体积x,则参加反应氧气的体积为2x,则甲烷的体积分数为:x/(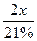 +x)×100%=9.5%,B选项错误;SO2与氧气的反应是可逆反应,所以1molSO2气体不可能完全转化,则放出的热量小于98.35KJ,C选项错误。
+x)×100%=9.5%,B选项错误;SO2与氧气的反应是可逆反应,所以1molSO2气体不可能完全转化,则放出的热量小于98.35KJ,C选项错误。
本题难度:一般
4、选择题 向100 mL BaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的总物质的量和加入混合溶液B的体积关系如图所示:
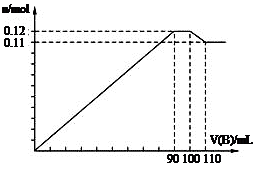
(1)当加入B溶液110 mL时,溶液中的沉淀是?。(填化学式)
(2)从90 mL至100 mL之间加入10 mLB溶液时,由图像纵坐标不变可知此段发生反应的离子方程式是:①?;②?;并由此可以分析出溶液B中Na2SO4与NaOH物质的量浓度之比为?。?
(3)通过计算分析可知:
B溶液中NaOH物质的量浓度为?mol/L;
A溶液中FeCl3物质的量浓度为?mol/L。
参考答案:(1)BaSO4、Fe(OH) 3(2分)
(2)①Ba2++SO42-== BaSO4↓(2分)?
②Al(OH) 3+ OH-== AlO2-+2H2O (2分)? 1:1(2分)
(3)c(NaOH)=" 1" mol/L(2分); c(FeCl3)=" 0.1" mol/L(2分)
本题解析:(1)当加入B溶液110 mL时,有图可知道刚开始生的沉淀分别为)BaSO4、Fe(OH) 3、Al(OH) 3,由于Al(OH) 3是两性物质,其可以溶解与过量的氢氧化钠溶液,所以溶液中的沉淀是BaSO4、Fe(OH) 3;(2)从90 mL至100 mL之间加入10 mLB溶液时,由图像纵坐标不变可知此段发生反应的离子方程式是:①Ba2++SO42-== BaSO4↓②Al(OH) 3+ OH-== AlO2-+2H2O,有图可以看出溶液B中Na2SO4与NaOH物质的量浓度之比为1:1;(3)由图可以知道铝离子的物质的量为0.02mol(10mL刚好消耗0.01mol的沉淀),钡离子的物质的量为0.1mol(10mL刚好生成0.01mol的沉淀,从开始到100mL),铁离子的物质的量为0.01mol,所以B溶液中NaOH物质的量浓度为1 mol/L,而A溶液中FeCl3物质的量浓度为 0.1 mol/L。
点评:本题考查了金属及其化合物,该考点是高考考查的重点和难点,本题要求学生要有一定的分析能力,该题有一定的难度。
本题难度:一般
5、选择题 相同物质的量的N2和CO两者相比较,下列叙述中不正确的是
A.所含分子数相等
B.所含原子总数相等
C.所含电子总数相等
D.所占的体积一定相等
参考答案:D
本题解析:A、正确,根据N=nNA知,N2和CO物质的量相等时,所含分子数相等.
B、正确,根据N=nNA知,相同物质的量的N2和CO所含分子数相等,每个分子中含有的原子数相等,所以相同物质的量的氮气和一氧化碳含有的原子数相同.
C、正确,根据N=nNA知,相同物质的量的N2和CO所含分子数相等,每个分子中含有的电子数都是14,所以相同物质的量的氮气和一氧化碳含有的电子数相同.
D、不正确,气体体积受温度和压强的影响,未注明温度和压强,气体摩尔体积不一定相等,所以相同物质的量的N2和CO所占的体积不一定相等.
选D.
本题难度:简单