1、实验题 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。
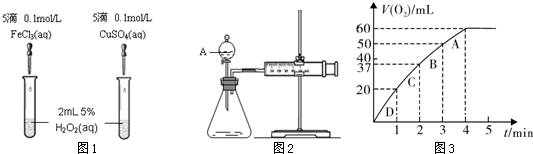
(1)定性分析:如图1可通过观察?,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是?。
(2)定量分析:如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是?。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式?。
②实验时放出气体的总体积是?mL。
③A、B、C、D各点反应速率快慢的顺序为:?>?>?>?。
解释反应速率变化的原因?。
④H2O2的初始物质的量浓度是??(请保留两位有效数字)。
参考答案:(1)产生气泡的快慢(1分);消除阴离子不同对实验的干扰(1分)
(2)产生40 mL气体所需的时间(1分)
(3)①2H2O2 2H2O+O2↑(1分)?②60(1分)
2H2O+O2↑(1分)?②60(1分)
③D C B A(1分);随着反应的进行,H2O2浓度减小,反应速率减慢(1分)
④0.11 mol/L(1分)
本题解析:⑴该反应中产生气体,所以可根据生成气泡的快慢判断;氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用;硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,答案为:两支试管中产生气泡的快慢;消除阴离子不同对实验的干扰;
⑵仪器名称分液漏斗,检查气密性的方法:关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位;该反应是通过生成气体的反应速率分析判断的,所以根据v=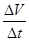 知,需要测量的数据是产生40ml气体所需要的时间,答案为:分液漏斗,关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位;产生40ml气体所需要的时间。
知,需要测量的数据是产生40ml气体所需要的时间,答案为:分液漏斗,关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位;产生40ml气体所需要的时间。
⑶从曲线的斜率可排知,反应速率越来越小,因为反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小;
)①在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2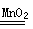 2H2O+O2↑;
2H2O+O2↑;
②根据图象知,第4分钟时,随着时间的推移,气体体积不变,所以实验时放出气体的总体积是60 mL;?
③根据图象结合v=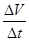 知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A;
知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A;
反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
④设双氧水的物质的量为x,
2H2O2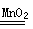 2H2O+O2↑
2H2O+O2↑
2mol? 22.4L
x? 0.06L
x=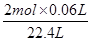 =0.0054mol,
=0.0054mol,
所以其物质的量浓度= ="0.11" mol·L-1,故答案为:0.11 mol·L-1.
="0.11" mol·L-1,故答案为:0.11 mol·L-1.
本题难度:一般
2、选择题 下列说法正确的是( )
A.分子的每一次碰撞都能够发生化学反应
B.反应物用量增加后,有效碰撞次数增多,反应速率增大
C.能够发生有效碰撞的分子叫做活化分子
D.加入催化剂对化学反应速率无影响
参考答案:A.分子发生有效碰撞时才能发生化学反应,故A错误;
B.反应物用量增加后,有效碰撞次数增多,但单位体积的有效碰撞不一定增大,即浓度不一定增大,如加入固体或纯液体,故B错误;
C.分子发生有效碰撞时发生化学反应,此时的分子为活化分子,故C正确;
D.加入催化剂可降低活化能,提高活化分子的百分数,反应速率增大,故D错误.
故选C.
本题解析:
本题难度:简单
3、简答题 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液
①
20mL?0.1mol?L-1
H2C2O4溶液
30mL?0.01mol?L-1
KMnO4溶液
②
20mL?0.2mol?L-1
H2C2O4溶液
30mL?0.01mol?L-1
KMnO4溶液
|
(1)该实验探究的是______因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是______>______(填实验序号).
(2)若实验①在2min末收集了4.48mL?CO2(标准状况下),则在2min末,c(MnO4-)=______mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定______来比较化学反应速率.
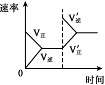
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速?率变快的主要原因可能是:①该反应放热、②______.
参考答案:(1)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,故答案为:浓度;②;①;
(2)CO2的物质的量是:4.48mL×10-322.4mol/l=0.0002mol,设2min末,反应(MnO4-)为X
? 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
? 2?10
? X? 0.0002mol
解得 X=0.00004mol
30mL×10-3×0.01mol?L-1-0.00004mol=0.00026mol
C(MnO4-)=nv=0.00026mol0.05L=0.0052mol/L
故答案为:0.0052;
(3)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,故答案为:KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间;
(4)催化剂能加快化学反应的速率,产物Mn2+(或MnSO4)是反应的催化剂,故答案为:产物Mn2+(或MnSO4)是反应的催化剂.
本题解析:
本题难度:一般
4、选择题 在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③移去生成物 ④增大压强 ⑤加入催化剂.
A.①③
B.②④
C.②⑤
D.①⑤
参考答案:增大反应物的浓度和增大压强,只能增大活化分子数,不能增大活化分子百分数,而②和⑤既能增大活化分子数,又能增大活化分子百分数,移去生成物,浓度降低,活化分子和活化分子的百分数都减小,
故选C.
本题解析:
本题难度:简单
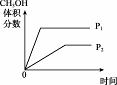
5、选择题 煤气化过程中生成的CO和H2一定条件下制甲醇的反应如下:
CO(g)+ 2H2(g) CH3OH(g) △H < 0。其他条件不变,改变某一条件后,用示意图表示的反应变化正确的是
CH3OH(g) △H < 0。其他条件不变,改变某一条件后,用示意图表示的反应变化正确的是
| A
| B
| C
| D
|
改变的条件
| 压强
| 温度
| 平衡体系增加H2
| 催化剂
|
变化的示意图
| 
| 
| 
| 
|
参考答案:A
本题解析:A、增大压强,反应速率加快,先到平衡,所以P1压强高,增大压强,平衡正向移动,甲醇的体积分数增大,所以正确,选A;B、温度升高,平衡逆向移动,氢气的转化率降低,错误,不选B;C、增加氢气,正反应速率增大,逆反应速率不变,正反应速率大于逆反应速率,平衡正向移动,所以错误,不选C;D、使用催化剂只能改变反应速率,不影响平衡,所以混合气体的总压强应该相等,所以错误,不选D。
考点:化学平衡图像分析,条件对反应速率和平衡的影响
本题难度:一般