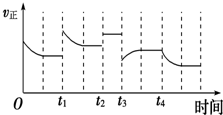
1、填空题 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4 (g)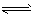 2NO2 (g) △H>O,隔一段时间对该容器内的物质进行分析得到如下数据:
2NO2 (g) △H>O,隔一段时间对该容器内的物质进行分析得到如下数据:

(1)求b、e的值:b=___,e=____。
(2)计算20s~40s内用N2O4表示的平均反应速率为___;80℃该反应的化学平衡常数K 为____。
(3)改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号)____。
A.向混合气体中再通入N2O4
B.保持容积不变,通入He
C.使用高效催化剂
D.降低温度
(4)如果在80℃时,将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2)____0.60mol(填“大于”、“等于”或“小于”)。
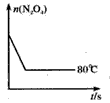
(5)如下图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。
2、选择题 在锌粒与盐酸反应中,改变下列条件不能加快反应速率的是
A.升高反应温度
B.增大盐酸的浓度
C.将小锌粒换成大锌粒
D.在盐酸中滴入几滴CuSO4溶液
3、选择题 将CoCl2溶解于盐酸中可以形成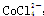 ,在溶液中存在下面的化学平衡:
,在溶液中存在下面的化学平衡:
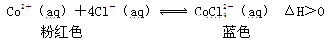
下列说法正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.该反应的平衡常数K=[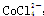 ] / [ Co2+][ Cl-]4
] / [ Co2+][ Cl-]4
C.将盛有CoCl2和盐酸混合液的试管置于热水中,试管内溶液为红色
D.增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小