| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《盐类水解的原理》考点预测(2019年强化版)(六)
参考答案:D 本题解析:醋酸是弱酸,部分电离,根据电荷守恒,溶液中c(H+)=c(CH3COO-)+c(OH-),A项错误;硫化钠是强电解质,电离出Na+和S2-,硫离子水解生成HS-,则溶液中离子浓度的大小关系为c(Na+)>c(OH-)>c(HS-)>c(H2S),B项错误;氨水是弱碱,pH =2的盐酸与pH =12的氨水等体积混合,溶液为氯化铵和氨水,溶液显碱性,C项错误;根据越弱越水解,酸性强弱的顺序为CH3COOH>H2CO3 >HClO,NaClO的水解能力最强,其次为NaHCO3,水解能力最弱的是CH3COONa ,则pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③,D项正确;选D。 本题难度:困难 3、选择题 0.1mol·L¯1 的Na2S溶液中,下面说法正确的是 |
参考答案:C
本题解析:A是电荷守恒,应该为:c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-) ,A错,B是物料守恒,应该是 c(Na+) =c(HS-) +c(S2-) +c(H2S),B错;S2-发生水解S2- +H2O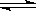 HS-+ OH-,水还会电离出OH-,故c(OH-)>c(HS-),C对;D是质子守恒,应该是2c(H2S)+ c(HS-)+ c(H+)= c(OH-),D错。选C
HS-+ OH-,水还会电离出OH-,故c(OH-)>c(HS-),C对;D是质子守恒,应该是2c(H2S)+ c(HS-)+ c(H+)= c(OH-),D错。选C
考点:盐类水解、离子浓度的大小比较。
本题难度:一般
4、选择题 下列过程或现象与盐类水解无关的是
[? ]
A. 热的纯碱液用于去油污
B. 加热氯化铁溶液颜色变深
C. 饱和食盐水使甲基橙显黄色
D. 泡沫灭火器中的Al2(SO4)3溶液不能装在铁筒里
参考答案:C
本题解析:
本题难度:简单
5、选择题 NH4Cl稀溶液中分别加入少量下列物质或改变如下条件,能使比值c(NH4+)/c(Cl—)一定增大的是
①HCl气体 ②氨气 ③H2O ④NH4Cl固体 ⑤NaOH固体 ⑥降温
A.③④⑤
B.②④
C.②③⑥
D.②④⑥
参考答案:D
本题解析:氯化铵中存在水解平衡,NH4Cl+H2O NH3·H2O+HCl。通入氯化氢,则抑制水解,但比值是减小的;通入氨气,抑制水解,比值增大;稀释促进水解,比值减小;加入氯化铵固体,抑制水解,比值增大;氢氧化钠固体促进水解,比值减小;水解吸热,降低温度,抑制水解,比值增大,因此正确的答案选D。
NH3·H2O+HCl。通入氯化氢,则抑制水解,但比值是减小的;通入氨气,抑制水解,比值增大;稀释促进水解,比值减小;加入氯化铵固体,抑制水解,比值增大;氢氧化钠固体促进水解,比值减小;水解吸热,降低温度,抑制水解,比值增大,因此正确的答案选D。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质组成与.. | |