|
高中化学知识点总结《盐类水解的原理》考点预测(2019年强化版)(八)
2019-03-14 22:37:34
【 大 中 小】
|
1、选择题 下列说法不正确的是:
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>c>b
B.常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>②
C.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性
D.物质的浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:③>①>②
|
参考答案:C
本题解析:A.一水合氨是弱碱,部分电离,在溶液中存在电离平衡含有未电离的电解质分子,而NaOH是强碱,完全电离,若将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,对于NaOH溶液来说,只有稀释作用,氨水中电离平衡正向移动,使溶液中c(OH-)减小的比NaOH少,所以稀释后溶液的c(OH-)氨水的大,pH变为b和c,则a、b、c的大小关系是:a>c>b ,正确;B.醋酸、盐酸都是酸,电离产生H+,对水的电离平衡起抑制作用,由于醋酸是弱酸,电离产生的H+的浓度小于等浓度的盐酸,所以抑制作用盐酸的大于醋酸;而醋酸钠是强碱弱酸盐,CH3COO-水解消耗水电离产生的H+,促进水的电离,使水的电离平衡正向移动,所以常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>②,正确;C.硫酸pH=3,则c(H+)=10-3mol/L,碱pH=11,则c(OH-)=10-3mol/L.如果BOH是一元强碱,则二者等体积混合后,H+与 OH-恰好反应,反应后溶液显中性;若BOH是弱碱,由于在溶液中含有电离未电离的BOH,当发生中和反应后未电离的BOH,会在电离,使溶液显碱性,错误;D.氯化铵溶液、硫酸铵都是强酸弱碱盐。水解使溶液显酸性,由于硫酸铵电离产生的铵根离子浓度大于氯化铵,所以溶液的酸性硫酸铵强,碳酸氢铵是弱酸弱碱盐,阳离子、阴离子都发生水解反应,水解相互促进,由于铵根水解程度小于碳酸氢根离子,所以溶液显碱性,故等物质的量浓度的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:③>①>②,正确。
考点:考查盐的水解平衡、弱电解质的电离平衡、酸碱混合溶液的酸碱性及弱电解质溶液稀释的知识。
本题难度:一般
2、填空题 (10分)氯化铁水解的离子方程式为  ______ ______ ___ , ______ ______ ___ ,
配制氯化铁溶液时滴加少量盐酸的作用是 ___ ;
若向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐逐渐溶解,并产生无色气体,其离子方程式为 ,
同时有红褐色沉淀生成的原因是 、
把FeCl3溶液蒸干后再灼烧,最后得到的主要固体产物是
参考答案:

本题解析:略
本题难度:一般
3、选择题 下列说法正确的是
A.在Na2CO3、NaHCO3两溶液中,离子种类不相同
B.在等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液中,阳离子总数相等
C.在NaHCO3和Na2CO3混合溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
D.在NaHCO3和Na2CO3混合溶液中一定有2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)]
参考答案:C
本题解析:碳酸钠溶液中碳酸根离子水解产生碳酸氢根离子,碳酸氢钠溶液中碳酸氢根离子电离产生碳酸根离子,两溶液中离子的种类相同,A错误;等物质的量的碳酸钠与碳酸氢钠溶液,溶液中阳离子的个数不相等,碳酸钠溶液中的阳离子较多,B错误;根据电荷守恒有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),C正确;D不属于质子守恒,所以答案选C。
本题难度:困难
4、实验题 (9分)某同学设计了如下实验探究盐的水解反应规律。
(1)向碳酸钠溶液中滴入几滴酚酞试液,溶液呈红色,用离子方程式表示其原因:
(2)用pH试纸测得硫酸铝溶液的pH为3,用离子方程式表示硫酸铝溶液呈酸性的原因: ;
简述测定该溶液的pH的操作方法是:
(3)将硫酸铝溶液和碳酸氢钠溶液混合,可观察到的现象是生成无色气体和絮状沉淀,写出该反应的离子方程式:
参考答案:(1). CO32-+H2O
本题解析:
本题难度:一般
5、填空题 A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如下图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列
问题:
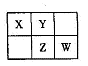
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3)AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高
反应速率,又能提高原料转化率的是 。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被200 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式 。
参考答案:(1)Cl2O7 
(2)Al(OH)3+NaOH=NaAlO2+2H2O
(3)Al3++3 H2O  Al(OH)3+3H+ Al(OH)3+3H+
(4)d
(5)NO3-、H+、NH4+、OH-
(6)2ClO2+2CN-=N2+2Cl-+2CO2
本题解析:
A是地壳中含量最多的金属元素,则A是Al;短周期中B的原子半径最大,B是Na;Z是最外层电子数是电子层的3倍,Z则是S,X、Y、W依次是N、O、Cl。
(1)W的最高价氧化物是Cl2O7;Z原子结构示意图为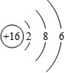 ; ;
(2)反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O
(3)AlCl3净水原理是,Al3+发生水解,Al3++3 H2O  Al(OH)3+3H+ ; Al(OH)3+3H+ ;
(4)提高转化率又能提高反应速率,选d。
(5)0.1mol NH3被0.2mol HNO3的溶液吸收后,是0.1molNH4NO3和0.1molHNO3组成的,由于NH4+能发生水解,离子浓度由大到小顺序为NO3-、H+、NH4+、OH-。
(6)2ClO2+2CN-=N2+2Cl-+2CO2
本题难度:困难
|