1、填空题 (6分)炭火炉内的炭燃烧至炽热时,在往炉膛底的热炭上喷洒少量水的瞬间,炉火更旺,这是因为?。
如果烧去“同量的炭,喷洒过水和没有洒过水的炭火炉相比,放出的总能量?(填“相同”或“不相同”),原因是? ? 。
参考答案:(每空2分,共6分)
生成的水煤气(CO和H2)燃烧,使得瞬间火焰更旺;相同;生成水煤气所吸收的热量和水煤气燃烧时增加的热量相同
本题解析:本题主要考查了生活现象与燃烧的相关知识,涉及到水的气化、盖斯定律等知识点,其中的反应为:
C+O2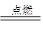 2CO2
2CO2
C+H2O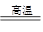 CO+H2? 2CO+O2
CO+H2? 2CO+O2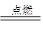 2CO2?2H2+O2
2CO2?2H2+O2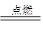 2H2O
2H2O
本题难度:简单
2、选择题 PH=4的醋酸和氯化铵溶液中,水的电离程度的关系前者与后者比较(?)
A.大于
B.小于
C.等于
D.无法确定
参考答案:B
本题解析:醋酸是弱酸,抑制水的电离。氯化铵溶于水水解促进水的电离,答案选B。
点评:该是基础性试题的考查,难度不大。该题的关键是明确水的电离平衡特点,以及外界条件是如何影响水的电离平衡的。
本题难度:简单
3、选择题 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-) )与pH的变化关系如图所示,则
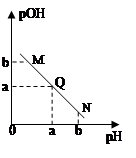
A.N点所示溶液中c(H+) < c(OH-)
B.M点所示溶液导电能力强于Q点
C.M点水的电离程度大于N点
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
参考答案:A
本题解析:向醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液的氢离子浓度逐渐减小,pOH减小。所以Q点溶液呈中性,M点溶液呈酸性,N点呈碱性。所以,A正确;B、Q点溶液强电解质溶液,M点溶液为弱酸,N点碱过量,所以导电能力N>Q>M;C、M点c(H+) = N点c(OH-),水的电离程度相同;D、Q点溶液呈中性,酸稍过量。
本题难度:一般
4、选择题 下列说法正确的是( )
①pH=2和pH=1的HNO3中c(H+)之比为1∶10
②0.2 mol·L-1与0.1 mol·L-1醋酸中,c(H+)之比大于2∶1
③Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
④纯水在100 ℃和20 ℃时,pH前者大
⑤同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
⑥100 mL 0.1 mol·L-1的醋酸与10 mL 1.0 mol·L-1的醋酸中H+的数目,前者多
A.①④⑤
B.①⑤⑥
C.①②⑤
D.①②③⑥
参考答案:B
本题解析:略
本题难度:一般
5、选择题 现有强酸甲溶液的pH=1,强酸乙溶液的pH=2,则酸甲与酸乙的物质的量浓度之比不可能的是( )
A.2∶1
B.5∶1
C.10∶1
D.20∶1
参考答案:A
本题解析:甲和乙中c(H+)之比为10:1。若甲和乙都是一元酸,则甲和乙浓度比为10:1;若甲是一元酸,乙是二元酸,则甲和乙浓度比为20:1;若甲是二元酸,乙是一元酸,则甲和乙浓度比为5:1。
点评:酸的浓度与c(H+)不一定一致。
本题难度:一般