1、选择题 已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g);△H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是(?)
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.稀硫酸与稀NaOH溶液反应的中和热△H=-57.3kJ/mol
D.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
参考答案:AC
本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以碳完全燃烧放热多,但放热越多,△H越小,选项A正确,B不正确;浓硫酸溶于水会放出大量的热,所以选项D不正确,C正确,答案选AC。
本题难度:一般
2、选择题 25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-a mol/L,下列说法正确的是?( )
A.a<7时,溶液的pH一定为a
B.a>7时,溶液的pH一定为14-a
C.a>7时,溶液的pH可能为a也可能为14-a
D.a<7时,水的电离受到抑制
参考答案:C
本题解析:a<7时,说明该溶液中水的电离是被促进的,而a>7时,该溶液中水的电离被抑制。酸或碱都是可以抑制水的电离,而盐类的水解可以促进水的电离,所以由水电离出的c(H+)=1×10-a mol/L的溶液的酸碱性无法确定,所以A、B、D都错误,C正确。答案选C。
点评:水是一种弱电解质,存在电离平衡,所以根据水的电离平衡方程式H2O H++OH-可以依据勒夏特例原理进行有关判断,其次还需要注意讨论。
H++OH-可以依据勒夏特例原理进行有关判断,其次还需要注意讨论。
本题难度:一般
3、选择题 1L0.1mol·L-1的K2SO4溶液中
A.K+的物质的量为0.1 mol
B.SO42-的物质的量为0.2mol
C.K+的物质的量浓度为0. 1mol·L-1
D.SO42-的物质的量浓度为0. 1mol·L-1
参考答案:D
本题解析:考查物质的量浓度的概念。单位体积溶液中所含有的溶质的物质的量,是物质的量浓度。硫酸钾比÷能电离出1个SO42-和2个K+,所以选项D是正确的。答案选D。
本题难度:简单
4、选择题 水的电离平衡曲线如图所示,下列说法不正确的是? ( )
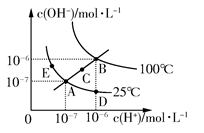
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
参考答案:C
本题解析:水的离子积常数只与温度有关,图中A、D、E三点的KW相等,都是25℃时水的电离平衡状态;B点是100℃时水的电离平衡状态,水的电离程度最大,KW最大;C点的KW介于A点和B点之间。从A点到D点,c(OH-)减小,c(H+)增大,溶液显酸性,可以采用加入少量酸的方法。从A点到C点,c(OH-)和c(H+)都增大,且增大之后仍然有c(H+)=c(OH-),应是温度升高所致,加入NH4Cl固体后溶液显酸性,C项错误。在B点时,KW=10-12,pH=2的硫酸中,c(H+)=0.01 mol/L;pH=10的KOH溶液中c(OH-)=0.01 mol/L,二者等体积混合时恰好反应,溶液显中性。
本题难度:一般
5、选择题 常温下,某溶液中由水电离出的c(OH-) = 1×10-5mol/L,则该溶液中的溶质是
A.CH3COONa
B.NaOH
C.NH3·H2O
D.KI
参考答案:A
本题解析:水的电离平衡:H2O H++OH-
H++OH-
由于c(OH-) = 1×10-5mol/L>1×10-7mol/L,说明水的电离被促进;CH3COONa中含有弱离子CH3COO—,可结合水中的H+,使平衡正向移动,符合题意
而NaOH、NH3·H2O可电离出OH-抑制水的电离,KI对水的电离平衡无影响
本题难度:一般