1、选择题 某温度下,反应H2(g)+I2(g)?2HI(g);△H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是( )
A.温度不变,压缩气体的体积,平衡不移动,混合气体颜色加深
B.温度、压强均不变,充人HI气体,开始时正反应速率增大
C.体积不变,升温正反应速率减小
D.体积、温度不变,充入氦气后,正反应速率将增大
参考答案:A.反应前后气体的化学计量数之和相等,压强对平衡移动没有影响,恒温,压缩体积,平衡不移动,但体积减小,浓度增大,所以颜色加深,故A正确;
B.恒压,充入HI(气),开始使反应物的浓度减小,则正反应速率减小,故B错误;
C.升高温度,正逆反应速率都增大,故C错误;
D.恒容恒温,充入惰性气体氦气,气体体积增大,压强减小平衡不移动,但反应速率减小,故D错误;
故选A.
本题解析:
本题难度:一般
2、填空题 某温度下,将2mol A和2.8 mol B充入体积为2 L的恒容密闭容器中,发生如下反应:
aA(g)+B(g) 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
(1) 5 min内用B表示该反应的化学反应速率为?。
(2)该温度下,此可逆反应的逆反应的平衡常数为?。
(3)a的值为?。
(4)下列说法一定能说明上述反应已达到平衡状态的是?。
①单位时间里每生成1molB的同时消耗了2mol的C?②D的物质的量不再变化
③混合气体的密度不再变化?④混合气体的平均相对分子质量不再变化
⑤体系的压强不再变化
(5)该温度下,某同学设计了以下实验,请在空格中填入热量(含Q的表达式表示)
起始
n(A)/mol
| 起始
n(B)/mol
| 起始
n(C)/mol
| 起始
n(D)/mol
| 达到平衡时放出(或吸收)的热量
|
0
| 1.6
| 8
| 足量
| ?
|
?
参考答案:(1) 0.04mol/(L·min) (2分) (2)? 6(2分) (3) 1 (2分) (4) ②③④ (2分) (5)8Q(2分)
本题解析:分析题意知,5 min后达到平衡。平衡时A为1.6mol,浓度为0.8 mol/L,从平衡体系中分离出四分之一的混合气体,相当于减小压强,剩余A的浓度为0.6mol/L,新平衡体系中c(A)仍为0.6mol/L,说明改变压强平衡不移动,该反应两边气体物质系数相等,a=1;利用三行式分析;根据题意知,
A(g)+B(g) 2C(g)+ D(s)
2C(g)+ D(s)
起始浓度(mol/L)? 1? 1.4? 0? 0
转化浓度(mol/L) 0.2? 0.2? 0.4?
平衡浓度(mol/L) 0.8? 1.2? 0.4
(1)根据公式V=Δc/Δt代入数据计算,5 min内用B表示该反应的化学反应速率为0.04mol/(L·min);(2)将平衡浓度代入该反应的平衡常数表达式计算,K=1/6,则逆反应的平衡常数为6;(3)由上述分析知,a=1;(4)化学平衡状态的判据:①用v正=v逆判断,双向同时,符合比例②用量判断,变量不变,已达平衡。恒量不能作为平衡标志。① 生成B和消耗C ,均为逆反应,不能作为平衡标志; ②D的 物质的量不再变化,可作平衡标志;③根据密度的定义式,混合气体的密度为变量,其不再变化,已达平衡;④根据M=m/n,气体的质量为变量,混合气体的平均相对分子质量为变量,其不再变化,已达平衡;⑤等温等容条件下,气体的物质的量为恒量,体系的压强为恒量,不能作平衡标志,综上所述选②③④;(5)根据等效平衡知识,两个投料途径会达到同一平衡状态,利用三行式分析,平衡时生成A为3.2mol,吸收的热量为8Q。
本题难度:困难
3、选择题 一定温度下,在容积固定的密闭容器中发生可逆反应A(g)+2B(g)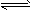 2Q(g)。平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q,则下列叙述中正确的是
2Q(g)。平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q,则下列叙述中正确的是
[? ]
A.刚充入时反应速率υ(正)减小,υ(逆)增大
B.达到新的平衡过程中,体系压强先增大,后逐渐减小
C.达到新的平衡时c(A):c(B):c(Q)仍为1:1:2
D.达到新的平衡时,反应混合物中A、B的体积分数增加
参考答案:B
本题解析:
本题难度:一般
4、选择题 若过程I与过程II温度相同,则关于反应N2O4(g)? 2NO2?(g)在下列过程中发生的变化描述正确的是
2NO2?(g)在下列过程中发生的变化描述正确的是

[? ]
A.a"?<b"、a?>b?
B.在平衡I向平衡II过渡的过程中,v(逆)?<v(正)
C.a">a、b"<b?
D.平衡II与平衡IV中N2O4的质量分数相等
参考答案:D
本题解析:
本题难度:一般
5、填空题 (14分) 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)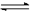 CO(g)+H2O(g),其化
CO(g)+H2O(g),其化
学平衡常数K与温度t的关系如下:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
请回答下列问题:(1)该反应的化学平衡常数K = 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)="0.01" mol/L, c(H2O)="0.03" mol/L, c(CO2)="0.01" mol/L, c(H2)="0.05" mol/L ,则反应开始时,H2O的消耗速率比生成速率 (填“大”、“小”或“不能确定”)
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 , H2的转化率为 。
参考答案:(1) K=c(CO)×c(H2O)/c(CO2)×c(H2) (2)吸热 (3)小
(4)CO2的转化率为1/3,H2的转化率为2/3。
本题解析:(1)由平衡常数的定义知该反应的化学平衡常数K的表达式为K=c(CO)×c(H2O)/c(CO2)×c(H2);
(2)由表中数据知随温度的升高K值增大,即平衡正向移动,而升温时,平衡向吸热反应方向移动,所以该反应为吸热反应。
(3)把起始浓度代入平衡常数的表达式中,得Q值=0.6,小于800℃时的K值=0.9,则反应将向正反应方向移动, H2O的消耗速率(表逆反应速率)比生成速率(表正反应速率)小;
(4)830℃时,平衡常数为1,设反应中转化的CO2浓度为x,则反应过程中物质浓度的变化情况为:
CO2(g) + H2(g)  CO(g) + H2O(g)
CO(g) + H2O(g)
起始(mol/l) 2 1 0 0
转化(mol/l) x x x x
平衡(mol/l) 2-x 1-x x x
据平衡常数的关系可得(2-x) (1-x )= x2,解得x=2/3,
则平衡后CO2的转化率为1/3,H2的转化率为2/3。
本题难度:困难