1、填空题 常温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
参考答案:
本题解析:
本题难度:一般
2、选择题 从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列电离平衡,故可用做酸、碱指示剂:
HIn(红色溶液)?H+(溶液)+In-(黄色溶液),在上述溶液中加入下列物质,最终能使指示剂显黄色的是( )
A.盐酸
B.NaHCO3溶液
C.NaHSO4溶液
D.Na2O2固体
参考答案:由HIn(红色溶液)?H+(溶液)+In-(黄色溶液),最终能使指示剂显黄色,则平衡正向移动,
A.加入盐酸,平衡逆向移动,指示剂显红色,故A不选;
B.加入NaHCO3溶液,氢离子与碳酸氢钠反应,平衡正向移动,指示剂显黄色,故B选;
C.加入NaHSO4溶液,电离产生氢离子,使平衡逆向移动,指示剂显红色,故C不选;
D.因过氧化钠固体具有强氧化性,能使指示剂褪色,故D不选;
故选B.
本题解析:
本题难度:一般
3、选择题 下列事实中,不能用勒夏特列原理解释的是( )
A.密闭、低温是存放氨水的必要条件
B.实验室常用排饱和食盐水法收集氯气
C.硝酸工业生产中,使用过量空气以提高NH3的利用率
D.合成氨反应采用较高温度和使用催化剂,以提高氨气的产量
参考答案:A.氨气和水的反应为NH3+H2O?NH3.H2O,该反应是可逆反应,所以可以用勒夏特列原理解释,故A不选;
B.氯气和水的反应方程式为:Cl2+H2O?HCl+HClO,该反应是可逆反应,所以可以用勒夏特列原理解释,故B不选;
C.氨气和氧气反应生成一氧化氮的方程式为:4NH4+5O2?4NO+6H2O,该反应是可逆反应,所以可以用勒夏特列原理解释,故C不选;
D.合成氨采用较高的温度是为了提高反应速率,催化剂对化学平衡无影响,所以不能用勒夏特列原理解释,故D选;
故选D.
本题解析:
本题难度:简单
4、填空题 (6分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
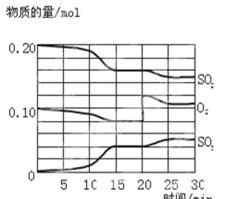
回答下列问题:
(1) 若降低温度,该反应的化学平衡常数 。(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 。
(3)反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。10 min到15 min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气 , 则平衡 ( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体 , 则平衡 ( 填“向左”或“向右”或“不”) 移动。
参考答案:(每空1分,共6分)
(1)增大;(2)15-20min,25-30min;(3)增大氧气的浓度,a、b;(4)不、向左
本题解析:(1)正反应是放热反应,所以降低温度,平衡向正反应方向进行,则平衡常数增大。
(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以根据图像可知,处于平衡状态的是15~20min,25~30min。
(3)反应进行至20 min时,氧气的浓度突然增大,而SO2的浓度逐渐减小,三氧化硫的浓度逐渐增大,所以改变的条件是增大氧气的浓度;根据图像可知,10 min到15 min时,物质的浓度变化量增大,即反应速率加快,所以改变的条件是使用了催化剂或改变了压强,答案选ab。
(4)条件不变,充入氮气,压强增大,但浓度是不变的,所以平衡不移动。维持容器体积不变,向该反应的平衡体系中移走部分混合气体,相当于降低压强,平衡向逆反应方向进行。
本题难度:困难
5、选择题 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
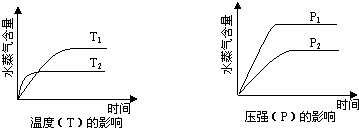
A.CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g);△H<0
B.CO2(g)+H2(g)?CO(g)+H2O(g);△H>0
C.CH3CH2OH?(g)?CH2=CH2(g)+H2O(g);△H>0
D.2C6H5CH2CH3(g)+O2(g)?2?C6H5CH=CH2(g)+2H2O(g);△H<0
参考答案:A
本题解析:
本题难度:简单