|
高中化学必备知识点《物质的量》高频试题特训(2019年最新版)(六)
2019-03-14 22:40:36
【 大 中 小】
|
1、选择题 下列说法正确的是(NA表示阿伏加德罗常数)(?)?
A.在常温常压下,1 mol氦气含有的原子数目为2NA
B.7.8克Na2O2与水完全反应,转移电子数为0.2 NA
C.1molSi3N4晶体中含有Si-N键的数目为12 NA
D.K37ClO3+6H35Cl=KCl+3Cl2↑+3H2O ,若生成Cl2分子数目为NA,
| 则其质量为72克
参考答案:C
本题解析:略
本题难度:一般
2、选择题 一定量的14%的KOH溶液,若将其蒸发掉100g水后,其质量分数为28%,体积为125mL,则浓缩后的KOH的物质的量浓度为( )
A.2.2mol/L
B.4mol/L
C.5mol/L
D.6.25mol/L
参考答案:设原KOH溶液的质量为x,则
x×14%=(x-100)×28%,
解得x=200g,
KOH的质量为200g×14%=28g,
则n=28g56g/mol=0.5mol,
所以浓缩后的KOH的物质的量浓度为0.5mol0.125L=4mol/L,
故选B.
本题解析:
本题难度:简单
3、计算题 (5分)将质量为2.3 g? Na用刺了孔的铝箔( Al )包裹后放入水中,一共只收集到1.792 L(标准状况)气体。若反应后溶液的体积为200 mL,则溶液中NaOH的物质的量浓度为多少mol·L-1?
参考答案:0.4 mol·L-1
本题解析:略
本题难度:一般
4、实验题 (8分)下图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。将上述硫酸进行稀释的实验操作是_____________________。
(3)在配制4.6 mol/L的稀硫酸的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中________;
②容量瓶用1 mol/L稀硫酸润洗________;
③定容时仰视观察液面________。
(4)常温下,某学生取出少量试剂瓶中的硫酸于一洁净试管中,加几片铝,结果铝片表面没有气泡产生,也未发现铝片溶解,试帮助该同学分析原因______________________。
参考答案:(1)18.4"? (2)62.5 将浓硫酸沿器壁缓慢注入水里,并不断用玻璃棒搅拌溶液
(3)①偏高"②偏高"③偏低? (4)常温下,铝在浓硫酸中发生“钝化”
本题解析:(1)根据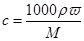 可知,硫酸的浓度是 可知,硫酸的浓度是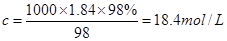 。 。
(2)由于容量瓶的规格没有240ml的,所以应该配制250ml,则需要浓硫酸的体积是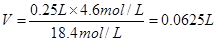 .由于浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水的,所以稀释的正确操作是将浓硫酸沿器壁缓慢注入水里,并不断用玻璃棒搅拌溶液。 .由于浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水的,所以稀释的正确操作是将浓硫酸沿器壁缓慢注入水里,并不断用玻璃棒搅拌溶液。
(3)根据c=n/V可知,未经冷却趁热将溶液注入容量瓶中,则根据热胀冷缩可知,溶液的体积偏少,浓度偏高;容量瓶用硫酸润洗,则溶质偏多,浓度偏高;定容时仰视观察液面,则溶液体积偏多,浓度偏小。
(4)由于常温下,铝在浓硫酸中发生“钝化”,所以铝不会溶解。
本题难度:一般
5、选择题 加热21.2g KOH和KHCO3的混合物使其充分反应后冷却,称得固体质量减少1.8g,则
下列说法中正确的是(n表示物质的量)
A.n(KOH) = 0.1mol
B.n(KOH) < n(KHCO3)
C.n(KHCO3) = 0.2mol
D.n(KOH) > n(KHCO3)
参考答案:D
本题解析:结合方程式: ①②KHCO3+ KOH="=" K2CO3 +H2O?②2KHCO3="=" K2CO3+ CO2+H2O,如果只有反应①发生,固体减少1.8g,混合物质量为15.6g,还剩余KOH5.6g,D正确;若还有②发生,减少的质量大于1.8g。
本题难度:一般
|