1、选择题
A.4Fe(OH)2+2H2O+O2===4Fe(OH)3↓
B.2Fe+2H2O+O2===2Fe(OH)2↓
C.2H2O+O2+4e-===4OH-
D.Fe-3e-===Fe3+
参考答案:D
本题解析:洗过的铁锅在空气中放置,可发生吸氧腐蚀。负极发生的反应为2Fe-4e-==2Fe2+,正极发生的反应为2H2O+O2+4e-===4OH-,总反应式为2Fe+2H2O+O2===2Fe(OH)2,而Fe(OH)2又被O2氧化为红褐色的Fe(OH)3。
本题难度:简单
2、选择题 常温时,将500 ml pH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的pH变为b(假设溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生。下列说法错误的是(?)
A.若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a)g CuCO3
B.b<a<7
C.阳极电极反应:2H2O—4e—=O2↑+4H+
D.整个过程中是阳极产生氧气,阴极析出铜单质
参考答案:A
本题解析:
本题的关键是看到在整个电解过程中始终发现只有一个电极有气体产生,马上就知道整个过程中是阳极产生氧气,阴极析出铜单质,要恢复电解前的溶液就要将氧气和铜的质量转化成CuO或CuCO3,需要20(10-b-10-a)g CuO。考虑水解a<7,电解转变成酸则b<a。
本题难度:一般
3、选择题 下图所示烧杯中均盛有海水,锌在其中被腐蚀的速率最慢的是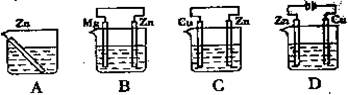
参考答案:B
本题解析:A、根据装置可知A装置是锌的化学腐蚀,A不正确;B、B装置是原电池,其中镁的金属性强于锌,因此镁是负极,失去电子被腐蚀。锌是正极被保护,属于牺牲阳极的阴极保护法,B正确;C、C装置也是原电池,其中锌的金属性强于铜,锌是负极失去电子,被腐蚀,C不正确;D、D装置是电解池,锌与电源的正极相连,做阳极失去电子加快腐蚀,D不正确,答案选B。
本题难度:一般
4、选择题 埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速度最慢的是( )
A.在含铁元素较多的酸性土壤中
B.在潮湿疏松透气的土壤中
C.在干燥致密不透气的土壤中
D.在含碳粒较多、潮湿透气的土壤中
参考答案:A、在呈酸性的潮湿土壤中,铁的锈蚀速度很快;
B、在潮湿、疏松、透气的土壤中,铁易生锈;
C、在干燥、致密、不透气的土壤中,铁不易生锈;
D、在含沙粒较多的潮湿土壤中,铁与水和氧气同时接触,易生锈;
故选C.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
[? ]
A.?葡萄糖在人体内的反应既属于氧化还原反应又属于吸热反应 ?
B.?钢铁易生锈被腐蚀,而铝、铜等金属不容易被腐蚀,是因为铁的活泼性强 ?
C.?氢燃料电池把氨气和氧气燃烧放出的热能转化为电能 ?
D.?在实验室使用大理石与稀盐酸反应制取CO2,是为了控制CO2生成的速率
参考答案:D
本题解析:
本题难度:简单