1、选择题 将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻铜片质量增加的是
A.硝酸
B.无水乙醇
C.石灰水
D.盐酸
参考答案:C
本题解析:铜片灼烧后生成CuO,插入硝酸或盐酸中,CuO都溶解,铜片质量减小,排除A、D两项.插入无水乙醇中,CuO又被还原为Cu,铜片质量不变,排除B项.插入石灰水中,CuO不发生变化,铜片质量增加,C项符合题意.
本题难度:困难
2、选择题 下列哪一种试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液? (? )
A.银氨溶液
B.浓溴水
C.新制Cu(OH)2浊液
D.FeCl3溶液
参考答案:C
本题解析:A.银氨溶液?遇到含有醛基的物质如?乙醛、甲酸能发生银镜反应,而不含有醛基的物质乙醇、乙酸则没有任何现象。只能把四种物质分为两组,不能再加以鉴别。错误。B.浓溴水与乙醛混合,溴水褪色,其余的无任何现象。不能鉴别。错误。C.新制Cu(OH)2浊液加入乙醇中,无任何现象,加入乙醛,无现象,若再加热煮沸,会产生砖红色沉淀;加入乙酸,会看到变为澄清溶液;加入甲酸,会看到变为澄清溶液,再再加热煮沸,会产生砖红色沉淀;现象个不相同,可以区别。正确。D.FeCl3溶液与四种混合都无任何现象发生。不能鉴别。错误。
本题难度:一般
3、实验题 某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管。请填写下列空白:

(1)甲装置常常浸在温度为70~80℃的水浴中,目的是?。
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜可丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
(3)乙醇的催化氧化反应是?反应(填“放热”或“吸热”),该反应的化学方程式为?。
(4)在实验过程中控制鼓气的速度很重要:
①控制鼓气速度的方法是?,
②若鼓气速度过快反应会停止,原因:?,
③若鼓气速度过慢反应也会停止,原因:?。
(5)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接?、?接丙。
参考答案:(1)适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;(3)放热;2CH3CH2OH+O2 2CH3CHO+2H2O;(4)①控制甲中单位时间内气泡数;②带走过多热量,难以保证反应所需温度;③反应放热太少,不能达到反应需要温度(5)b;a
2CH3CHO+2H2O;(4)①控制甲中单位时间内气泡数;②带走过多热量,难以保证反应所需温度;③反应放热太少,不能达到反应需要温度(5)b;a
本题解析:(1)甲装置常常浸在温度为70~80℃的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气,故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;(3)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应;乙醇发生催化氧化生成乙醛和水,故答案为:放热;2CH3CH2OH+O2 2CH3CHO+H2O;(3)①鼓气的速度越快,甲中单位时间内冒出的气体就越多,反之,越少,故答案为:控制甲中单位时间内气泡数;②鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度,导致反应停止,故答案为:鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度;③鼓气速度过慢反应放热太少,不能达到反应需要温度,导致反应停止,故答案为:反应放热太少,不能达到反应需要温度;(4)为防止防止丁中水倒吸,安全瓶中的导气管是“短进长出”,所以长导管有缓冲作用;故答案为:b;a。
2CH3CHO+H2O;(3)①鼓气的速度越快,甲中单位时间内冒出的气体就越多,反之,越少,故答案为:控制甲中单位时间内气泡数;②鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度,导致反应停止,故答案为:鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度;③鼓气速度过慢反应放热太少,不能达到反应需要温度,导致反应停止,故答案为:反应放热太少,不能达到反应需要温度;(4)为防止防止丁中水倒吸,安全瓶中的导气管是“短进长出”,所以长导管有缓冲作用;故答案为:b;a。
本题难度:一般
4、填空题 (本题共12分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。
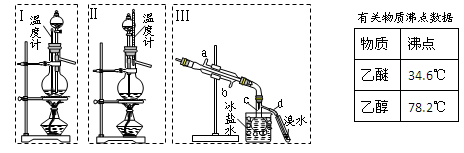
1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择______(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是_________________。
2.Ⅲ中水冷凝管的进水口是______(选答“a”或“b”)。冰盐水的作用是___________。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)_______。
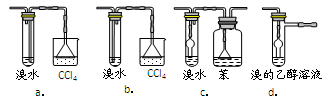
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中所有生成气体的反应方程式____________________________。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:
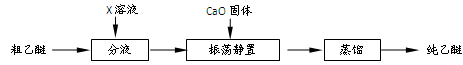
(1)分液步骤除去产品中的酸性杂质,则X可以是________________。
(2)蒸馏操作可除去的杂质是____________。
6.工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)______________。
a.CCl4、萃取? b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤? d.酸化的FeSO4溶液、分液
参考答案:(本题共12分)
1.(1)I。(2)防止乙醇挥发。
2.b。冷凝液化乙醚。
3.c、d(2分)。
4.CH3CH2OH+6H2SO4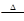 2CO2↑+6SO2↑+9H2O;C+2H2SO4
2CO2↑+6SO2↑+9H2O;C+2H2SO4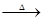 CO2↑+2SO2↑+2H2O;CH3CH2OH
CO2↑+2SO2↑+2H2O;CH3CH2OH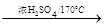 C2H4↑+H2O;CH3CH2OH+2H2SO4
C2H4↑+H2O;CH3CH2OH+2H2SO4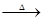 2C+2SO2↑+5H2O(2分,1分1个,合理就给分)。
2C+2SO2↑+5H2O(2分,1分1个,合理就给分)。
5.(1)NaOH(合理就给分)。(2)乙醇(CH3CH2OH)。?
6.b、d
本题解析:1.(1)温度计应该测量反应液的温度。
2.Ⅲ中水冷凝管的进水口下口,这样可使冷水方向与热气体的方向相反,冷凝效果好。
3.有机试剂尽量不要开口放置于空气中,防止其挥发。
4.170℃时,在乙醇脱水生成乙烯的同时,乙醇可被氧化为C和CO2,同时硫酸被还原为SO2,
6.除去过氧化物应该先具有还原性的Na2SO3溶液、FeSO4溶液。
本题难度:一般
5、实验题 某实验小组用下列装置进行乙醇催化氧化的实验。
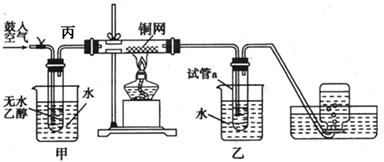
⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
?、?。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是?反应。
⑵甲和乙两个水浴作用不相同。
甲的作用是?;乙的作用是?。
⑶反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是?、?、
?。集气瓶中收集到的气体的主要成分是?。
⑷若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有?。要除去该物质,可现在混合液中加入?(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填实验操作名称)即可得到乙醛。
⑸图中丙处导管应倾斜的原因是?。
⑹本实验中若不鼓入空气,其他操作不变,乙处试管内也得到了乙醛,则发生的化学方程式为?。
参考答案:⑴2Cu+O2 2CuO? CH3CH2OH+CuO
2CuO? CH3CH2OH+CuO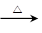 CH3CHO+Cu+H2O?放热
CH3CHO+Cu+H2O?放热
⑵加热?冷却?⑶乙醛?乙醇?水?氮气?⑷乙酸? c?蒸馏
⑸使冷凝的乙醇蒸汽易于回流
⑹CH3CH2OH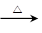 CH3CHO+H2
CH3CHO+H2
本题解析:(1)在加热的条件下,铜被氧化生成红色的氧化铜。实验过程中铜网出现红色和黑色交替的现象,说明生成的氧化铜又被还原重新生成了铜单质,即氧化铜被乙醇还原,而乙醇被氧化生成了乙醛。熄灭酒精灯,反应仍能继续进行,说明反应一定水放热反应。
(2)反应中需要乙醇的蒸汽,所以甲通过加热来产生乙醇气体。乙醇的氧化产物是乙醛,常温下是液体,所以通过乙冷却得到乙醛液体。
(3)由于反应中乙醇气体不可能被完全氧化。所以在试管a中一定含有没有来得及反应的乙醇,所以a中的物质有乙醇、乙醛和水。空气中的氮气不参与反应,最好通过排水法收集到集气瓶中。
(4),试纸显红色,说明溶液显酸性,即部分乙醛被氧化生成了乙酸。所给的物质只有碳酸氢钠和乙酸反应,所以通过碳酸氢钠来除去乙酸,由于乙醛和水是互溶的,所以应通过蒸馏得到乙醛
(5)丙处导管应倾斜主要是为了冷凝的乙醇蒸汽易于回流,增大产率
(6)乙醇脱氢发生了氧化。
本题难度:一般