1、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,30 g的2-丙醇中含有羟基的数目为0.5 NA
B.标准状况下,11.2 L乙炔中含有共用电子对的数目为1.5NA
C.1 mol·L-1的碳酸钠溶液中含有CO32-的数目小于NA
D.常温下,1 molO2和O3的混合气体中含有氧原子的数目为2.5NA
参考答案:A
本题解析:A、30 g÷60 =0.5mol,正确;B、0 .5×5=0.25mol,错误;C、溶液没有体积,不能计算物质的量,错误;D、氧原子数目在2mol——3mol范围内,错误。
本题难度:一般
2、选择题 NA代表阿伏加德罗常数,下列有关叙述正确的是(? )
A.标准状况下,2.24 L H2O含有的分子数等于0.1NA
B.1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.1mol Na2O2晶体中含有的阴离子数目为2NA
参考答案:B
本题解析:选B。A不正确,水在标准状况下是液体;B、正确;C、不正确,要标准状况;D、不正确,O22―是原子团,含有的阴离子数目为1NA
本题难度:一般
3、选择题 下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A.10 g NaOH固体溶解在水中配成250 mL溶液
B.将80 g SO3溶于水并配成1 L的溶液
C.将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D.标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
参考答案:C
本题解析:A、10 g NaOH固体溶解在水中配成250 mL溶液:c(NaOH)=10g?40g/mol?0.25L=1mol/L。A正确。
B、将80 g SO3溶于水并配成1 L的溶液,三氧化硫溶于水,与水反应生成硫酸,为硫酸溶液,根据三氧化硫质量计算硫酸的物质的量,再根据物质的量浓度定义计算判断:根据硫原子守恒可知n(H2SO4)=n(SO3)=80g?80g/mol=1mol,所以溶液浓度为1mol/L,故B正确。
C、由蒸发前后溶质的物质的量不变,但溶液的密度不等于水的密度,体积之差不等于质量之差,故C错误。
D、标况下,将22.4 L氯化氢气体溶于水配成1 L溶液:22.4L?22.4L/mol ?1L=1mol/L。
点评:考查学生对物质的量浓度理解,浓度减小,注意物质的量浓度表达式中体积为溶液体积,不是溶剂体积
本题难度:一般
4、计算题 (8分)臭氧(O3)能与KI溶液反应,生成O2等。在反应后的溶液中滴入酚酞变为红色,若滴入淀粉则变为蓝色。为测定某环境空气中的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使之完全反应,所得溶液用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点。反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI。
(1)臭氧通入KI溶液中的化学方程式:
(2)滴定过程中选择的指示剂是 ,达到滴定终点时的现象为 ;
(3)计算该空气中臭氧的体积分数。
参考答案:(8分)
(1) ===
===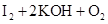 (2分)
(2分)
(2)淀粉 (1分) 溶液由蓝色变为无色(1分)
(3)由化学方程式得:
O3————————————I2————————————2Na2S2O3
1mol 2mol
n(O3) 0.0100mol/L×0.0600L
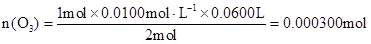 ………………(2分)
………………(2分)
则大气中臭氧的体积分数为: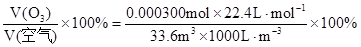
 ……………………………………(2分)
……………………………………(2分)
本题解析:
(1)臭氧通入KI溶液中,臭氧作为氧化剂,碘化钾被氧化生成碘单质,方程式为 ===
===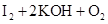 ;
;
(2)Na2S2O3溶液滴定到终点时,碘单质恰好反应完全,此时若加入淀粉作为指示剂,溶液颜色则有蓝色变为无色。
(3)根据这两个方程式: ===
===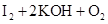 ;
; ,找出O3与Na2S2O3关系如下:
,找出O3与Na2S2O3关系如下:
O3————————————I2————————————2Na2S2O3
1mol 2mol
n(O3) 0.0100mol/L×0.0600L

计算臭氧的体积分数是: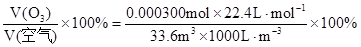 =
=
考点:考查酸碱中和滴定知识、氧化还原反应方程式的书写及化学计算。
点评:氧化还原反应方程式的书写及中和滴定数据的处理是高中学生学习的一个难点,容易失分,本题属于中等题。
本题难度:困难
5、选择题 设NA表示阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,0.2mol SO2与足量O2充分反应,生成SO3分子数为0.2NA
B.0.1mol—NH2(氨基)中含有的电子数为0.7NA
C.3.4g H2O2中含有的共用电子对数为0.1NA
D.常温常压下,16g O2和O3混合气体含有的氧原子数为NA