1、选择题 下列说法或表示方法正确的是
[? ]
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s) △H=-1. 90kJ/mol可知,金刚石比石墨稳定
C.氢气的燃烧热285. 8kJ/mol,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) △H=+285. 8kJ/mol
D.在稀溶液中H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol。若将含0. 5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
参考答案:D
本题解析:
本题难度:简单
2、选择题 将V1mL1.0mol·L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
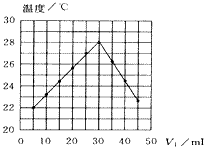
[? ]
A.做该实验时环境温度为22℃
B.该实验表明化学能可转化为热能
C.NaOH溶液的物质的量浓度约为1.0mol/L
D.该实验表明有水生成的反应都是放热反应
参考答案:B
本题解析:
本题难度:一般
3、实验题 试回答下列中和热测定的有关问题:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑 料、泡沫塑料板、环形玻璃搅拌棒、0. 50 mol/L的盐 酸、0.55 mol/L的NaOH溶液,尚缺少的实验用品是_______________。
(2)实验时所用盐酸及NaOH溶液的体积均为 50 mL,各溶液的密度为1 g/cm3,生成溶液的比热容 c=4. 18 J/(g.℃),实验起始温度为T1℃,终止温 度为T2℃。试推断中和热的计算式:____________。
参考答案:(1)温度计、量筒(两个)
(2)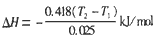 或△H=-16.72(T2-T1)kJ/mol
或△H=-16.72(T2-T1)kJ/mol
本题解析:
本题难度:一般
4、简答题 (1)已知20.0gNaOH稀溶液跟足量稀盐酸反应,放出28.68kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量______kJ,由此测得的中和热为______kJ/mol.
(2)已知断开1molH-H键、1mol?Br-Br键、1mol?H-Br键分别需要吸收的能量为436kJ、193kJ、366kJ.?计算H2和Br2反应生成1mol?HBr需______(填“吸收”或“放出”)能量______kJ.
参考答案:(1)NaOH+HCl=NaCl+H2O
? 40g?18g
?20g?xg
x=9g
设生成18g水放出热量为QkJ,有18:9=Q:28.68,
Q=57.36,
中和热为生成1mol水放出的热量,中和热为57.36kJ/mol,
故答案为:57.36;57.36;
(2)H2和Br2反应生成1mol?HBr,
则断裂化学键吸收的能量为:0.5mol×436kJ/mol+0.5mol×193kJ=314.5kJ,
形成1molH-Br键放出的能量为:366kJ,
314.5kJ<366kJ,
所以反应放热,放出的热量为:366kJ-314.5kJ=51.5kJ,
故答案为:放出;?51.5.
本题解析:
本题难度:一般
5、选择题 关于化学能与热能的叙述,正确的是
[? ]
A.1mol酸与碱恰好中和时所放出的热量叫中和热
B.化学反应中的能量变化,主要是由化学键的变化引起的
C.需要加热才能发生的反应,一定是吸热反应
D.反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应
参考答案:B
本题解析:
本题难度:一般