| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《有关氧化还原反应的计算》考点巩固(2019年最新版)(十)
参考答案:D 本题解析:CN-中碳的化合价为+2价,生成二氧化碳的价态为+4价,化合价升高被氧化,作还原剂,A错误;1 L含CN-1.02 mg/L的物质的量为0.00102g/16g/mol=0.00007mol,2CN-~5Cl2,故需氯气的物质的量为0.00007x2.5=0.000105mol,B错误;反应前后阴离子的数目不变,故C错误;根据反应方程式每生成2mol二氧化碳转移10mol电子,故生成0.4mol二氧化碳转移2mol电子,D正确,答案选D。 本题难度:一般 4、选择题 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的化学方程式是:4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH 工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下: |
参考答案:C
本题解析:A、根据高铁酸钾的化学式(K2FeO4)可知,设铁元素的化合价为x,则+1×2+x+(-2)×4=0,解得x=+6,故A正确;B、正确,铁由+3价变成+6价;C、不正确,干法中每生成1 mol Na2FeO4转移(4+1)="5" mol电子,其中1摩电子式过氧化钠自己-1价氧间转移的。D、正确。与水反应生成Fe (OH)3能吸附水中的悬浮杂质,显强氧化性,将还原剂氧化。答案选C.
考点:氧化还原反应
本题难度:一般
5、选择题 将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
参考答案:C
本题解析:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故A错误; B、根据方程式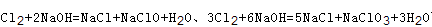 可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式
可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式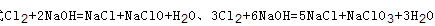 可知,氧化产物只有NaClO时,转移电子数最少,为
可知,氧化产物只有NaClO时,转移电子数最少,为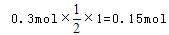 氧化产物只有NaClO3时,转移电子数最多,为
氧化产物只有NaClO3时,转移电子数最多,为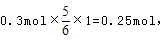 故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
考点:考查氧化还原反应计算、根据方程式的计算等相关知识点
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《胶体》高频.. | |