1、填空题 (1)现有以下物质:
①NaCl溶液;②液态SO3;③乙醇(C2H5OH);④熔融的KNO3;⑤BaSO4固体;⑥干冰;Cu
其中:属于电解质的是______(用序号填写)
(2)已知铜在加热条件下能与浓H2SO4反应,产物为CuSO4、SO2、H2O,写出该反应的化学方程式______,其中发生氧化反应的物质是______,用双线桥法表示出上述反应的电子转移的方向和数目:
______.
(3)已知离子反应:RO3n-+6I-+6H+═R-+3I2+3H2O,试求RO3n-中R的化合价______.
(4)一个完整的氧化还原反应方程式可以拆写成两个“半反应”,一个是氧化反应,一个是还原反应,如:2H++Zn=Zn2++H2↑拆写的结果是:氧化反应Zn-2e-=Zn2+还原反应2H++2e-=H2↑,据此,请将反应2Fe3++Cu=2Fe2++Cu2+拆写成两个“半反应”式,氧化反应:______,还原反应:______.
(5)某溶液中只有Na+、Al3+、Cl-、SO42-四种离子.已知Na+、Al3+、Cl-的个数比为3:2:1,则溶液中Al3+与SO42-的个数比为______.
参考答案:(1)电解质为在水溶液或者熔融状态下能够导电的化合物,满足该条件的为:熔融的KNO3、⑤BaSO4固体,
故答案为:④⑤;
(2)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O,反应中铜被氧化,发生氧化反应,用双线桥法分析该反应为: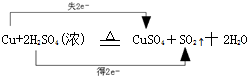 ,
,
故答案为:Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O;铜; ;
;
(3)RO3n-+6I-+6H+═R-+3I2+3H2O中一定满足电荷守恒,则+6-n-6=-1,解得n=1,则R的离子为:RO3-,设R的化合价为 x,则:x+(-2)×3=-1,解得:x=+5,
故答案为:+5;
(4)2Fe3++Cu=2Fe2++Cu2+中铜失去电子,化合价升高发生氧化反应,反应的离子方程式为:Cu-2e-=Cu2+;铁离子得到电子,化合价降低被含有,发生还原反应,反应的反应为:2Fe3++2e-=2Fe2+,
故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+(或Fe3++e-=Fe2+);
(5)溶液中只有Na+、Al3+、Cl-、SO42-四种离子,已知Na+、Al3+、Cl-的个数比为3:2:1,设Na+、Al3+、Cl-的个数分别为3x、2x、x,硫酸根离子的数目为y,则根据溶液电中性可知,3x+2x×3=x+y×2,解得y=4x,则溶液中Al3+与SO42-的个数比为:2x:4x=1:2,
故答案为:1:2.
本题解析:
本题难度:简单
2、选择题 高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上通常用下列反应先制得高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在某低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾,下列有关说法不正确的是( )
A.Na2O2在反应中既作氧化剂,又作还原剂
B.制取高铁酸钠时,每生成lmolNa2FeO4反应中共有4mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小
D.K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
参考答案:B
本题解析:解析:A.Na2O2在反应中,没有全部生成O2,O元素的化合价分别变为-2价、0价,则Na2O2在反应中既作氧化剂,又作还原剂,故A正确;
B.反应中Fe的化合价有+3价升高为+6价,每生成lmolNa2FeO4反应中共有3mol电子转移,故B错误;
C.加入KOH固体,可析出高铁酸钾,说明高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小,故C正确;
D.K2FeO4具有强氧化性,可杀菌消毒,Fe(OH)3胶体具有吸附性,可用来净水,故D正确.
故选B.
本题难度:一般
3、简答题 (1)在反应NaClO+SO2+H2O=NaCl+H2SO4中,氧化剂是______,氧化产物是______;
在反应3NO2+H2O=2HNO3+NO中,还原产物是______,氧化剂与还原剂的物质的量之比为______.
(2)按要求写出下列反应的离子方程式
①氯气与氢氧化钙溶液反应:______;
②硫酸铝溶液与氨水反应:______;
③写出Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O:______.
参考答案:(1)在反应NaClO+SO2+H2O=NaCl+H2SO4中,NaClO中氯元素得电子化合价降低,所以次氯酸钠是氧化剂,二氧化硫中硫元素失电子化合价升高,二氧化硫是还原剂,氧化产物是硫酸,还原产物是氯化钠;在反应3NO2+H2O=2HNO3+NO中,二氧化氮中氮元素的化合价既有升高的也有降低的,所以二氧化氮既是氧化剂又是还原剂,还原产物是一氧化氮,氧化剂与还原剂的物质的量之比为1:2.
故答案为:NaClO;H2SO4;NO;1:2.
(2)①氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O.
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
②硫酸铝和氨水反应生成氢氧化铝和铵根离子,离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+.
故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+.
③硫酸氢钠和氢氧化钡反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O.
故答案为:Ba2++OH-+H++SO42-=BaSO4↓+H2O.
本题解析:
本题难度:一般
4、填空题 为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
(1)图1表示该反应过程中能量变化,则该反应为______反应(填“吸热”或“放热”),判断依据是______;
(2)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的电池装置.
①该电池正极的电极反应式为:______;
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为:______;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______;
(4)为了消除污染,在一定条件下,向含有甲醇的废水中加入一定量的稀硝酸,会有N2等物质生成.若参加反应的氧化剂和还原剂的物质的量之比为6:5,写出该反应的化学方程式______;在此反应过程中若消耗32g?甲醇,将转移______mol?电子.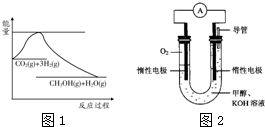
参考答案:(1)由图1可知,反应物的总能量高于生成物的总能量,故该反应为放热反应,故答案为:放热;反应物的总能量高于生成物的总能量;
(2)①原电池正极发生还原反应,氧气在正极放电,碱性条件下生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②该原电池实质为甲醇燃烧生成二氧化碳与水,二氧化碳在与氢氧化钾反应生成碳酸钾与水,该原电池总的反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,
故答案为:2CH3OH+3O2+4KOH=2K2CO3+6H2O;
(3)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由盖斯定律,①-②+③×4得2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l),故△H=-1275.6kJ∕mol-(-566.0kJ/mol)+(-44.0kJ/mol)×4=-885.6?kJ∕mol,
故CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8?kJ∕mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8?kJ∕mol;
(4)反应中硝酸为氧化剂,甲醇为还原剂,根据电子转移守恒,令C元素在氧化产物的化合价为a,则:
6×5=5×[a-(-2)],解得a=4,故氧化产物为CO2,反应方程式为:5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O,
甲醇的物质的量为32g32g/mol=1mol,反应C元素化合价由-2价升高为+4,故转移电子的物质的量为1mol×[4-(-2)]=6mol,
故答案为:5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O;6;
本题解析:
本题难度:一般
5、选择题 近期,质检部门在众多品牌乳制品中检出有毒有机物三聚氰胺[C3N3(NH2)3],其分子结构如图所示.在乳制品行业掀起了一场轩然大波,引发了一场关于食品安全问题的大讨论.三聚氰胺是一种重要的有机化工原料,因其含氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标,因此三聚氰胺也被人称为“蛋白精”.三聚氰胺遇强酸或强碱水溶液水解,氨基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3].三聚氰酸可用于消除汽车尾气中的NO2,其反应原理为:C3N3(OH)3=3HNCO;8HNCO+6NO2=7N2+8CO2+4H2O.下列说法正确的是( )
A.反应中NO2是还原剂
B.HNCO是一种很强的氧化剂
C.C3N3(OH)3与HNCO为同一物质
D.有1?mol?NO2参与反应转移电子的物质的量为4?mol