1、选择题 已知:①能量越低的物质越稳定,②白磷转化成红磷放出热量。
据此,下列判 断或说法中正确的是
A.在相同的条件下,红磷比白磷稳定
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的结构相同
D.红磷容易发生自燃而白磷则不会自燃
参考答案:A
本题解析:白磷转化成红磷放出热量则白磷的能量比红磷的能量高,而能量越低的物质越稳定,所以红磷更稳定。A正确。C选项中红磷和白磷是同素异形体,结构不相同,组成的元素相同。D选项,白磷在加热至300℃时会发生破裂,成为红磷,白磷在空气中44℃即发生自燃,而红磷的着火点为240℃,因此白磷更容易自燃。
点评:本题联系反应热先判断白磷与红磷的能量谁高,再判断谁更稳定。C和D选项则涉及到了结构和化学性质,需要学生记忆基本的化学知识。
本题难度:简单
2、选择题 下列说法正确的是(?)
A.需要加热的化学反应都是不自发反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.太阳能电池是将化学能转化为电能的过程
参考答案:B
本题解析:反应多自发性和焓变以及熵变有关系,需要加热的化学反应也可能是自发进行的,A不正确。中和反应都是放热反应,B正确;原电池是将化学能转化为电能的一种装置,C不正确;太阳能电池是将太阳能转化为电能的过程,D不正确,答案选B。
点评:该题是基础性试题的考查,难度不大。主要是考查学生对常见能量转化对熟悉了解程度,有利于培养学生的学习兴趣,激发学生的学习积极性。
本题难度:简单
3、选择题 下列现象或反应的原理解释正确的是
参考答案:D
本题解析:A:由于铝箔外层的氧化层薄膜的熔点高,将熔化的铝包裹其中,故不滴落
B:合成氨反应为放热反应,但为了提高反应速率,特别是保证催化剂活性,必须在高温下进行
C:由于金属活性锌>铁>锡,在镀层破损后,镀锡铁形成的原电池中,铁作负极,相对易腐蚀
D:正确
本题难度:一般
4、选择题 学好自然科学知识是改造自然的基础。自然科学知识告诉我们,物质的能量越低,该物质越稳定。下列含氮物质中,能量最低的是?(?)。
A.氨气
B.氮气
C.一氧化氮
D.硝酸
参考答案:B
本题解析:在所给的物质中,氮气是最稳定的,所以氮气的能量最低,答案选B。
点评:该题是信息给予题,也是高考中的常见题型。试题基础性强,旨在考查学生灵活运用基础知识解决实际问题的能量,有利于培养学生的自学能力和知识的迁移能力。
本题难度:简单
5、填空题 (1)已知热化学方程式如下:N2(g)+3H2O(1)==2NH3(g)+ O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
(2)明矾能净水的原因: (用离子方程式和必要的文字解释)
___________________________________________________________________________。
(3)已知FeCl3能水解 ,则配制FeCl3溶液的方法是 ____?。
(4)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
铁锅的锈蚀是?腐蚀(填“析氢”或“吸氧”)
写出铁锅腐蚀负极的电极反应式:?
正极的电极反应式:?
参考答案:(1) 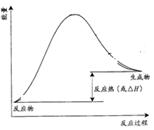 ?(2分);
?(2分);
(2)因为明矾溶于水发生Al3++3H2O Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质。(2分)
Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质。(2分)
(3)将FeCl3固体溶解在浓盐酸中,再加水稀释至所需浓度。(2分)
(4)吸氧腐蚀(1分),2Fe-4e-=2Fe2+(2分), O2 + 2H2O + 4e-= 4OH-(2分)
本题解析:(1)根据反应的热化学方程式可知,该反应是吸热反应,所以反应物的总能量低于生成物的总能量,则图像是(见答案)。
(2)因为明矾溶于水电离出的铝离子发生水解反应,Al3++3H2O Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质,所以明矾可以作为净水剂。
Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质,所以明矾可以作为净水剂。
(3)FeCl3能水解,溶液显酸性,所以配制FeCl3溶液的方法是将FeCl3固体溶解在浓盐酸中,再加水稀释至所需浓度。
(4)钢铁的腐蚀主要是吸氧腐蚀,其中负极是铁失去电子,电极反应式是2Fe-4e-=2Fe2+。正极是氧气得到电子,则电极反应式是O2 + 2H2O + 4e-= 4OH-。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,侧重对学生基础知识的巩固与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:一般