1、选择题 下列反应中,是吸热反应的是(? )
A.铁片与稀硫酸反应
B.甲烷在空气中燃烧
C.单质钠与水反应
D.Ba(OH)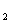 ·8H
·8H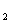 O晶体与氯化铵晶体反应
O晶体与氯化铵晶体反应
2、填空题 (16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产?的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是?(填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
?。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g)?△H=?。
2SO3(g)?△H=?。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:

①求该温度时,氨水的电离平衡常数K=?。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
①? a ??b?(填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)=?。
(用含有a、b的式子表示)
3、填空题 合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
?时间/h
物质的量/mol
| 0
| 1
| 2
| 3
| 4
|
N2
| 2.0
| 1.83
| 1.7
| 1.6
| 1.6
|
H2
| 6.0
| 5.49
| 5.1
| 4.8
| 4.8
|
NH3
| 0
| 0.34
| 0.6
| 0.8
| 0.8
|
?
①0~2 h内,v(N2)=?。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)  ?N2(g)+3H2(g)的平衡常数K=?。
?N2(g)+3H2(g)的平衡常数K=?。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为?(填选项字母)。
A.a=l、b=3.c=0?B.a=4、b=12、c=0
C.a=0、b=0.c=4?D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为?。
(3)采用高质子导电性的SCY陶瓷(能传递H"),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)  2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入?___极,该电极反应式为?。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入?___极,该电极反应式为?。
4、选择题 下列化学反应属于吸热反应的是(?)
A.碘的升华
B.生石灰溶于水
C.镁与稀盐酸反应
D.氢氧化钡与氯化铵晶体混合
5、选择题 下列热化学方程式书写正确的是(?)
A.C(s)+O2(g)=CO2(g)ΔH=+393.5 kJ/mol
B.2SO+O2=2SO3ΔH=-196.6 kJ/mol
C.H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8 kJ/mol
D.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ