1、选择题 采用循环操作可提高原料的利用率,下列工业生产中,没有采用循环操作的是( )
A.硫酸工业
B.合成氨工业
C.硝酸工业
D.氯碱工业
参考答案:D?
本题解析:硫酸工业中对尾气要进行第二次氧化,采用了循环操作。合成氨工业中未转化的N2和H2要循环到压缩机重新反应;硝酸工业吸收塔中由NO2转化成的NO要循环操作。
本题难度:简单
2、选择题 下列化学肥料均属于复合肥料的是( )。
A.KH2PO4和NH4Cl
B.NH4Cl和NH4NO3
C.KNO3和KH2PO4
D.NH4Cl和KNO3
参考答案:C
本题解析:复合肥料是指含有两种或两种以上营养元素(通常指氮、磷、钾元素)的化肥。上述物质中,KH2PO4含有K、P两种营养元素,KNO3含有K、N两种营养元素,它们都属于复合肥料。
本题难度:一般
3、实验题 (本小题15分)根据下列框图关系填空,已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为无色液体,H与E相对分子质量之间的关系为:Mr(H) -Mr(E) =34,又知C焰色反应火焰呈黄色。
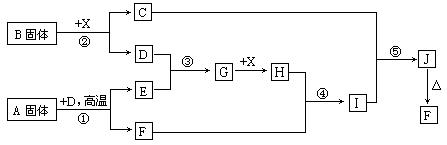
(1) 反应②的化学方程式:__________________________________;
产物C的电子式:_______________________。
(1)化合物A中所包含的化学键有:_______________________。
(2)反应④的离子方程式:_______________________________。
反应⑤的化学方程式:__________________________________。
(3)已知每生成16g E,放出106.5 kJ热量,则反应①的热化学方程式为:
_________________________________________________________ 。
参考答案:(1) 2Na2O2+2H2O===4NaOH+O2↑(2分)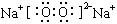 (2分)
(2分)
(1)离子键、非极性键 (3分,答出1个只给1分)
(2)Fe2O3 + 6H+ = 2Fe3+ + 3H2O(2分)
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓+3Na2SO4(2分)
(3)FeS2(s) + 11/4 O2(g) =" 1/2" Fe2O3(s)+ 2SO2(g);△H=-852kJ/mol(4分)
本题解析:抓住反应①、③是工业生产中的重要反应这个突破口,再结合A是固体,得出:反应①是煅烧FeS2制SO2,X是无色液体,应为水,③是制SO3,②是固体B与水作用产生O2,则固体B为过氧化钠,其他就好解了。技能空间:本题解题突破口是“重要工业生产反应”。中学重要工业生产反应有:1.煅烧石灰石 2.煅烧黄铁矿 3.二氧化硫的催化氧化 4.氨的催化氧化 5.合成氨 6.电解饱和食盐水 7.工业制盐酸 8.高炉炼铁 9.工业制取漂粉精 10.工业制水煤气 11.硅酸盐工业等。
应试策略:有一类框图推断题,考查中学所学的工业生产原理,并结合元素化合物的知识,综合考查工业生产中常见化合物的性质,有一定的综合性。题目有一定难度,除有扎实的基本功外,还要有一定灵活运用知识的能力,较强的推理能力。
本题难度:一般
4、选择题 下列措施符合“绿色化学”思想的是( )
A.直接排放含磷生活污水
B.大量使用氟里昂作为冰箱制冷剂
C.使用可降解塑料代替不可降解塑料
D.使用化学性质稳定、不易分解的有机氯农药
参考答案:C
本题解析:
本题难度:一般
5、选择题 有关接触法制硫酸的叙述,其中正确的是…( )
A.用硫或黄铁矿均可作为原料
B.尾气含二氧化硫,进入接触室以前不需再净化处理
C.送进沸腾炉的矿石不需粉碎,燃烧黄铁矿应不断添加燃料
D.接触室中的热交换器的作用是冷却沸腾炉出来的炉气
参考答案:A
本题解析:接触法制硫酸,关键是将SO2与O2通过催化剂(V2O5)的作用,接触氧化为SO3,至于获得SO2,可以将硫燃烧而得,也可以燃烧黄铁矿(主要成分FeS2)而得,所以A说法正确。尾气中含有SO2,但其含量极少,在实际生产中没有价值再送入接触室去氧化,一般作回收处理。块状矿石不易燃烧,故必须粉碎,从化工生产原理上讲叫做增大反应物接触面积,有利于加快化学反应速率。另外黄铁矿燃烧过程是放热的,所以点燃以后不需添加燃料。接触室中的热交换器的作用是加热进入接触室的SO2和O2混合气体,同时冷却反应后生成的SO3气体。
本题难度:简单