1、选择题 将1molCO和1molH2O充入容器中,在催化剂存在下发生反应H2O?(g)+CO(g)?

H2?(g)+CO2(g)
达到平衡时,发现有50%的CO转化为CO2.在其他条件不变的情况下,若将1molCO和2molH2O充入反应器中,则反应达平衡后,混合气体中CO2的体积分数可能为( )
A.
B.
C.
D.
参考答案:由到平衡时,发现有50%的CO转化为CO2,则
? H2O?(g)+CO(g)?

H2?(g)+CO2(g)
开始1? 1? 0? 0
转化?0.5? 0.5? 0.5?0.5
平衡?0.5? 0.5? 0.5?0.5
则CO2的体积分数为0.50.5+0.5+0.5+0.5=14,
若将1molCO和2molH2O充入反应器,CO的转化率为100%,则
? ?H2O?(g)+CO(g)?

H2?(g)+CO2(g)
开始2? 1? 0? 0
转化?1? 1? ?1? 1
平衡?1?0? 1? ?1
CO2的体积分数为11+0+1+1=13,
即CO的转化率介于50%--100%之间,所以CO2的体积分数介于14--13之间,
29介于16--13之间,故选C.
本题解析:
本题难度:一般
2、选择题 高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.升高温度,逆反应速率减小
B.该反应的焓变为正值
C.恒温恒容下,增大压强,H2浓度一定减小
D.该反应的化学方程式为CO+H2O??CO2+H2
参考答案:平衡常数k=c(CO)?c(H2O)c(CO2)?c(H2),所以该反应化学方程式应为CO2+H2
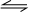
CO+H2O.
A、温度升高,正逆反应都增大,故A错误;
B、恒容时,温度升高,H2浓度减小,平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即该反应的焓变为正值,故B正确;
C、恒温恒容下,增大压强,如果是加入稀有气体的话,各物质浓度没有变,所以平衡不移动,此时各物质的浓度不会变化,若增大二氧化碳浓度,H2浓度一定减小,若中等CO或水的浓度,H2浓度一定增大,故C错误;
D、平衡常数k=c(CO)?c(H2O)c(CO2)?c(H2),所以该反应化学方程式应为CO2+H2
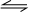
CO+H2O,故D错误.
故选B.
本题解析:
本题难度:简单
3、填空题 在一定温度下,在1L容器中m?molSO2和n?mol?O2,反应达到平衡时有q?molSO2发生了反应,试填写下列空白:
(1)达到平衡时,c(SO2)=______
(2)平衡时气体总的物质的量为______
(3)在其它条件不变时,压缩容器使压强增大该反应的速率会______;或者减少SO2的量反应速率会______.
参考答案:(1)n(SO2)平衡=mmol-qmol=(m-q)mol,所以平衡时,c(SO2)=(m-q)mol1L=(m-q)mol/L,故答案为:(m-q)mol/L;
(2)2SO2+O2 ?2SO3,物质的量减少
?2mol? 1mol
?qmol? q2mol
所以平衡时气体总的物质的量为mmol+nmol-q2mol=(m+n-q2)mol,
故答案为:(m+n-q2)mol;
(3)压强增大反应加快,反应速率增大,降低反应物浓度反应速率减慢,则减少SO2的量会使反应速率减小.
故答案为:增大;减小.
本题解析:
本题难度:一般
4、选择题 一定条件下的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)?ΔH=-905.9 kJ· mol-1,下列叙述正确的是
4NO(g)+6H2O(g)?ΔH=-905.9 kJ· mol-1,下列叙述正确的是
[? ]
A.4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ?
B.平衡时,v正(O2)=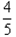 v逆(NO)
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大?
D.平衡后升高温度,混合气体中NO含量降低
参考答案:D
本题解析:
本题难度:一般
5、选择题 为了探索外界条件对反应 的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。以下判断正确的是
的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。以下判断正确的是
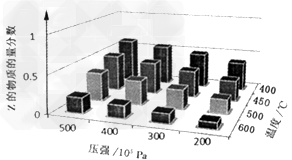
[? ]
A.△H>0,a+b>c
B.△H>0,a+b<c
C.△H<0,a+b>c?
D.△H<0,a+b<c
参考答案:C
本题解析:
本题难度:一般