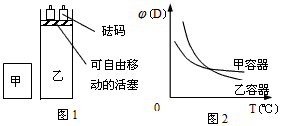
1、选择题 一定温度下,2A(g)+2B(g) C(g)+2D(g);ΔH<0。现将2mol A和2mol B充入体积为V的甲容器中,将2mol C和4mol D充入乙容器中,调节砝码,使初始体积为2V。下列有关说法正确的是
C(g)+2D(g);ΔH<0。现将2mol A和2mol B充入体积为V的甲容器中,将2mol C和4mol D充入乙容器中,调节砝码,使初始体积为2V。下列有关说法正确的是
[? ]
A.甲容器中的反应先达到化学平衡
B.两容器中的反应均达到平衡时,甲容器中混合气体的平均摩尔质量较大
C.若将两容器达到平衡后再升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
D.若在甲容器中再充入2mol A和2mol B,平衡后甲容器中的C的浓度是原平衡状态下的2倍
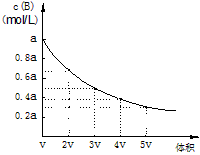
2、选择题 在一密闭容器中,反应mA(g) nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
[? ]
A.物质B的质量分数增加
B.平衡向逆反应方向移动
C.物质A的转化率减小
D.化学计量数:m>n
3、填空题 工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2?(g) 2SO3(g)?△H=-196.6?kJ·mol-1
2SO3(g)?△H=-196.6?kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2?
B.向装置中充入过量的SO2
C.向装置中充入O2?
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol?SO2?和2mol?O2?及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为?5mol?SO2(g)、3.5?mol?O2(g)、1mol?SO3(g)?,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ?
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等?
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550?℃时,将2.0?mol?SO2和1.0?mol?O2置于 5?L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10?M?Pa。试计算反应 2SO3 2SO2+O2?在550?℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10?MPa)?_________K(1.0?MPa)(填?“<”或“>”或“=”)。
2SO2+O2?在550?℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10?MPa)?_________K(1.0?MPa)(填?“<”或“>”或“=”)。

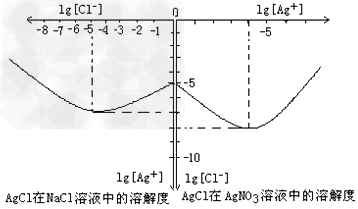
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl?+?Cl-?=[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________?
4、选择题 如图所示,容器中间是一个可左右滑动的隔板,若容器材料的导热性很好,能保持容器左、右侧温度一致。起始时向左侧的容器中加入1 mol N2、3 mol H2,右侧容器中加入2 mol A2、2 mol B2进行反应,达到平衡。下列说法正确的是

[? ]
A.平衡时隔板仍在正中间
B.左侧反应的反应速率一定小于右侧反应的反应速率
C.当达到平衡时,若升温隔板一定会发生移动
D.若人为地将隔板向右推动,由于右侧平衡不受压强影响,故隔板可停留在所推动的位置上
5、选择题 一定温度下改变反应容器体积使压强变化,但不会使下列化学反应的平衡发生移动的是( )
A.2SO2(g)+O2(g)?2SO3(g)
B.2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)
C.C(s)+CO2(g)?2CO(g)
D.Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)