1、选择题 下列有关水溶液中的离子问题的叙述中正确的是( )
A.pH=12的氨水和pH=2的盐酸溶液等体积混合,c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=11的氨水溶液稀释后,恢复至原温度,pH和Kw均减小
C.向一定量的醋酸溶液中逐滴加入物质的量浓度相同的氢氧化钠溶液,直至氢氧化钠过量,在实验过程中水的电离程度的变化趋势是先小后大
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
参考答案:A、pH=2的盐酸中c(H+)=10-2mol/L,pH=12的氨水中c(OH-)=10-2mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,所以溶液中离子浓度相对大小顺序为c(NH4+)>c(Cl-)>c (OH-)>c(H+),故A错误;
B、将氨水稀释后,溶液中氢氧根离子的物质的量浓度变小,导致溶液的PH值变小;但水的离子积常数只与温度有关,与溶液的浓度无关,所以温度不变,水的离子积常数不变,故B错误;
C、酸能电离出氢离子,碱能电离出氢氧根离子,所以酸和碱都能抑制水的电离;当向一定量的醋酸溶液中逐滴加入物质的量浓度相同的氢氧化钠溶液,溶液的酸性逐渐减弱,所以水的电离逐渐增强;当氢氧化钠过量,溶液变成碱性,碱性溶液也抑制水的电离,所以在实验过程中水的电离程度的变化趋势是先大后小,故C错误;
D、向硫化钠溶液中加氯化银时,氯化银和硫化钠反应生成更难溶的硫化银,导致溶液中c(S2-)下降,故D正确;
故选D.
本题解析:
本题难度:一般
2、选择题 将pH=1的盐酸平均分成2份,1份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A.9:1
B.10:1
C.1l:1
D.12:l
参考答案:C
本题解析:
本题难度:简单
3、填空题 (1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)?2NH3(g)+
O2(g)△H=akJ?mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323
NH3生成量/(10-6mol)
4.8
5.9
6.0
|
①此合成反应的a______0;△S______0,(填“>”、“<”或“=”)
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1,则上述合成反应中a=______kJ?mol-1
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为______酸(填“强”或“弱”),H2A的电离方程式为______,该溶液中由水电离出的c(H+)=______.
(3)一定温度下,两种酸:a、盐酸b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a______b(填“>”、“<”或“=”,下同);
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a______b.
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a______b.
参考答案:(1)①由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,则正反应应为吸热反应,a>0,由方程式可知反应生成气体的物质的量增多,则△S>0,
故答案为:>;>;
②已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1,
则利用盖斯定律,将①×2-②×3可得常温下氮气与水反应生成氨气与氧气的热化学方程式为:
2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=2×(-92.4kJ?mol-1)-3×(-571.6kJ?mol-1)=+1536kJ?mol-1,
所以其热化学反应方程式为:2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=+1536kJ?mol-1,
第(1)题中氮气的计量数是1,则a=12(+1536kJ?mol-1)=+768kJ?mol-1 ,
故答案为:+768kJ?mol-1;
(2)常温下,0.1mol/L的某酸H2A的pH=4,说明该酸部分电离,则为弱酸,H2A是二元弱酸,分步电离,第一步电离方程式为:H2A?H++HA-,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以该溶液中由水电离出的c(H+)=10-1410-4mol/L=10-10 mol/L,
故答案为:弱;H2A?H++HA-;10-10 mol/L;
(3)醋酸是弱电解质,醋酸溶液中存在醋酸电离平衡,氯化氢是强电解质,
①醋酸部分电离,氯化氢完全电离,所以当两种酸的物质的量浓度相同时,c(H+):a>b,
故答案为:>;
②在pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,pH、体积相同的两种酸溶液醋酸的物质的量大于盐酸,两种溶液中加入过量的铁粉,反应结束时生成H2的总体积:a<b,
故答案为:<;
③在pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,稀释过程中促进醋酸电离,则醋酸溶液中氢离子浓度大于盐酸,所以将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a>b,
故答案为:>.
本题解析:
本题难度:简单
4、选择题 常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,下列说法正确的是( )
A.c(CH3COO-)=c(Na+)时.该溶液一定呈中性
B.c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全中和?
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,不一定是醋酸过量
D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列说法不正确的是
[? ]
A.25℃时,pH =1的HNO3和pH =1的CH3COOH等体积混合后所得溶液的pH约为1
B.25℃时,Mg(OH)2悬浊液中由Mg(OH)2电离出的c(OH-)≈10-4mol/L,则Mg(OH)2悬浊液的pH约为10
C.25℃pH =a的NaOH溶液和pH=b的NaOH溶液等体积混合pH为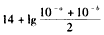
D.25℃时,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该强碱溶液的pH为10.5
参考答案:C
本题解析:
本题难度:一般