| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《键参数——键能、键长与键角》高频考点预测(2019年最新版)(六)
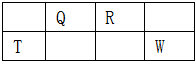 参考答案:短周期元素Q、R、T、W,根据元素所处的位置,可确定T、W为第三周期的元素,Q、R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为C元素,R为N元素,W为S元素, 本题解析: 本题难度:一般 3、简答题 (2008?上海,23)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(2)写出C单质与水反应的化学方程式______.A与C形成的化合物溶于水后,溶液的pH______7(填“大于”“等于”或“小于”). (3)D元素最高价氧化物晶体的硬度______(填“大”或“小”),其理由是______. (4)A、B两元素非金属性较强的是(写元素符号)______.写出能证明这一结论的一个实验事实______. 参考答案:(1)B元素从“气体”可知是非金属元素,从M层上有7个“电子”知是Cl元素,位于元素周期表第三周期ⅦA族, 本题解析: 本题难度:一般 4、填空题 已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出12种元素的X的数值:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是______。 (2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系______________________________。 (3)请你预测Br与I元素的X数值的大小关系________。 (4)某有机物结构简式为: 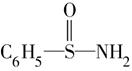 ,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。 ,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。(5) 预测元素周期表中,X值最小的元素位置________(放射性元素除外)。 参考答案:(1)共价键?(2)元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强)原子半径越小,X的数值越大? (3)Br大于I? (4)N? 本题解析:由表中数据可以看出,元素X的数值越大,元素的非金属性越强,所以可以得出,Br的X值小于Cl(2.8),故Al与Br的X值的差值小于1.7,则形成的化学键为共价键;因为N的非金属性大于C,而C和S的X值均为2.5,所以N的X值必定大于S,故S-N中,共用电子对将偏向于N原子;X值最小的元素则金属性最强的元素,为Cs,位于第六周期第Ⅰ主族。 本题难度:一般 5、填空题 根据下列表示物质组成的微观示意图,回答下列问题。 参考答案:(1)B (2)C、D (3)C 本题解析:(1)B中包含3种分子,属于混合物;(2)C、D中的物质都是由同种元素构成,并且均有一种分子,属于纯净物,自然属于单质;(3)C中物质的分子是单原子分子,符合题意。 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《物质的量》高频考.. | |