| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《离子方程式的书写及正误判断》考点巩固(2019年最新版)(四)
参考答案:B 本题解析:解题的关键是根据离子反应条件找出参加反应的离子,然后再根据离子的来源判断书写的正误。A选项中应注明生或物Fe(OH)3为胶体,A不正确,B正确;C、D两选项电荷不守恒,皆不正确。 本题难度:一般 2、填空题 (12分)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。 参考答案:(1)NO3- + Al +H2O→ Al(OH)3 + N2 + OH-(2分) 5∶3 本题解析:(1)根据金属铝将水体中的NO3-转化为N2,可知Al为还原剂,则Al(OH)3为氧化产物,再根据电荷守恒和原子守恒可得:NO3- + Al +H2O→ Al(OH)3 + N2 + OH-;Al元素被氧化,N元素被还原,则被氧化与被还原的元素的物质的量分别为x、y,由电子守恒可知,x×(3-0)=y×(5-0),解得x:y=5:3,所以被氧化与被还原的元素的物质的量之比为5∶3。 本题难度:困难 3、填空题 (10分)下图中,A、B、C、D、E是常见单质,其中B、C、E为金属。G、H、I、F是B、C、D、E分别和A形成的化合物,G物质有磁性。已知:①C与G反应生成B和H且放出大量的热,该反应可用于焊接铁轨;②I是一种常见的温室气体,它和E可以发生反应: 参考答案:(1)8Al+ 3Fe3O4 本题解析:(1)A、B、C、D、E是常见单质,其中B、C、E为金属。C与G反应生成B和H且放出大量的热,该反应可用于焊接铁轨;则为铝热反应,C与G反应的化学方程式为8Al+ 3Fe3O4 本题难度:一般 4、选择题 离子方程式H++OH-===H2O可表示强酸和强碱生成可溶性盐这一类中和反应。下列物质间的反应能用该离子方程式表示的是 |
参考答案:A
本题解析:①稀H2SO4+Ba(OH)2溶液反应,生成硫酸钡沉淀和水,不能用H++OH-===H2O表示;②澄清石灰水+稀HNO3,能用;③Cu(OH)2是难溶的弱碱,写化学式,不能用;④醋酸是弱酸,写化学式,不能用;⑤Ba(OH)2溶液+稀HNO3,能用;⑥氨水是弱碱,写化学式,不能用;选A。
考点:考查离子方程式。
本题难度:一般
5、选择题 下列离子方程式书写正确是的
A.碳酸钙投入醋酸溶液中:CaCO3+2H+ =Ca2++H2O+CO2↑
B.电解氯化镁溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.氯化银溶于氨水:AgCl+2NH3·H2O =Ag(NH3)2+ +Cl-+2H2O
D.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:Ba2++H++SO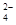 +OH-= BaSO4↓+H2O
+OH-= BaSO4↓+H2O
参考答案:C
本题解析:A.碳酸钙投入醋酸溶液中:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,A错误; B.电解氯化镁溶液:Mg2++2Cl-+2H2O Cl2↑+H2↑+2Mg(OH)2,B错误;C.氯化银溶于氨水:AgCl+2NH3·H2O =Ag(NH3)2+ +Cl-+2H2O,C正确;D.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:Ba2++2H++SO
Cl2↑+H2↑+2Mg(OH)2,B错误;C.氯化银溶于氨水:AgCl+2NH3·H2O =Ag(NH3)2+ +Cl-+2H2O,C正确;D.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:Ba2++2H++SO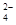 +2OH-= BaSO4↓+2H2O,D错误;选C。
+2OH-= BaSO4↓+2H2O,D错误;选C。
考点:考查离子方程式的书写。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《药物的成分.. | |