1ЎўјтҙрМв іБөнОпІў·Зҫш¶ФІ»ИЬЈ¬ЗТФЪЛ®ј°ёчЦЦІ»Н¬өДИЬТәЦРИЬҪв¶ИУРЛщІ»Н¬Ј¬Н¬АлЧУР§УҰЎўВзәПОпөДРОіЙөИ¶ј»бК№іБөнОпөДИЬҪв¶ИУРЛщёДұдЈ®ТСЦӘAgCl+Cl-ЁT[AgCl2]-Ј¬ИзНјКЗДіОВ¶ИПВAgClФЪNaClИЬТәЦРөДИЬҪвЗйҝцЈ®
УЙТФЙПРЕПўҝЙЦӘЈә
ЈЁ1Ј©УЙНјЦӘёГОВ¶ИПВAgClөДИЬ¶И»эіЈКэОӘ______Ј®
ЈЁ2Ј©AgClФЪNaClИЬТәЦРөДИЬҪвіцПЦИзНјЛщКҫЗйҝцЈЁПИұдРЎәуұдҙуЈ©өДФӯТтКЗЈә______
ЈЁ3Ј©ЙијЖКөСйЦӨГчSЈЁAgClЈ©ЈҫSЈЁAgIЈ©ЈҫSЈЁAg2SЈ©Ј¬КөСй·Ҫ°ёКЗ______
ЈЁ4Ј©ИфФЪAgClРОіЙөДЧЗТәЦРөОјУ°ұЛ®УРКІГҙПЦПуЈҝ______·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘ______Ј®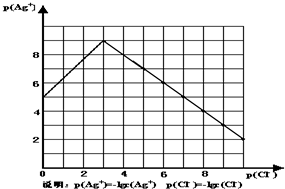
ІОҝјҙр°ёЈәЈЁ1Ј©AgClөДИЬ¶И»эіЈКэKsp=cЈЁAg+Ј©?cЈЁCl-Ј©=10-9mol/L?10-3mol/L=10-12Ј¬№Кҙр°ёОӘЈә10-12Ј»
ЈЁ2Ј©ёщҫЭіБөнИЬҪвЖҪәвЈәAgClЈЁsЈ©=Cl-ЈЁaqЈ©+Ag+ЈЁaqЈ©Ј¬Ҫ«ВИ»ҜТш·ЕФЪВИ»ҜДЖЦРЈ¬Cl-ТЦЦЖБЛAgClөДИЬҪвЈ¬ө«Cl-ЕЁ¶ИФцҙуК№AgClРОіЙВзәПОпЈәAgCl+Cl-ЁT[AgCl2]-Ј¬
№Кҙр°ёОӘЈәCl-ТЦЦЖБЛAgClөДИЬҪвЈ¬ө«Cl-ЕЁ¶ИФцҙуК№AgClРОіЙВзәПОпЈәAgCl+Cl-ЁT[AgCl2]-Ј»
ЈЁ3Ј©ёщҫЭSЈЁAgClЈ©ЈҫSЈЁAgIЈ©ЈҫSЈЁAg2SЈ©Ј¬ІўЗТіБөнПтЧЕёьДСИЬөДОпЦКЧӘ»ҜЈ¬ҝЙТФЙијЖКөСй·Ҫ°ёКЗЈәПтAgClРьЧЗТәЦРөОјУKIПЎИЬТәЈЁ0.1mol/LЈ©Ј¬№ММеУЙ°ЧЙ«ЧӘ»ҜОӘ»ЖЙ«Ј¬ФЩПтРьЧЗТәЦРөОјУН¬ЕЁ¶ИNa2SПЎИЬТәЈЁ0.1mol/LЈ©Ј¬№ММеУЙ»ЖЙ«ЧӘ»ҜОӘәЪЙ«Ј¬
№Кҙр°ёОӘЈәПтAgClРьЧЗТәЦРөОјУKIПЎИЬТәЈЁ0.1mol/LЈ©Ј¬№ММеУЙ°ЧЙ«ЧӘ»ҜОӘ»ЖЙ«Ј¬ФЩПтРьЧЗТәЦРөОјУН¬ЕЁ¶ИNa2SПЎИЬТәЈЁ0.1mol/LЈ©Ј¬№ММеУЙ»ЖЙ«ЧӘ»ҜОӘәЪЙ«Ј»
ЈЁ4Ј©ВИ»ҜТшДЬәН°ұЛ®·ҙУҰЙъіЙОЮЙ«Тш°ұИЬТәИЬТәЈ¬ПЦПуКЗЈә°ЧЙ«іБөнИЬҪвЈ¬РОіЙОЮЙ«ИЬТәЈ¬
КөЦКОӘЈәAgCl+2NH3=AgЈЁNH3Ј©2++Cl-Ј¬
№Кҙр°ёОӘЈә°ЧЙ«іБөнИЬҪвЈ¬РОіЙОЮЙ«ИЬТәЈ»AgCl+2NH3=AgЈЁNH3Ј©2++Cl-Ј®
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
2ЎўСЎФсМв Рн¶аВнВ·БҪЕФөДКчёЙ¶јҫщФИөШНҝДЁБЛКҜ»ТЛ®ЎЈПВБРУР№ШЛө·ЁІ»ХэИ·өДКЗ
[? ]
AЈ®ұҘәНКҜ»ТЛ®ЦРјУИлЙъКҜ»ТЈ¬ИфОВ¶ИІ»ұдЈ¬ФтИЬТәЦРCa2Ј«өДОпЦКөДБҝІ»ұд
BЈ®ұҘәНКҜ»ТЛ®ЦРјУИлЙъКҜ»ТЈ¬ИфОВ¶ИІ»ұдЈ¬ФтpHІ»ұд
CЈ®ЙэёЯұҘәНКҜ»ТЛ®өДОВ¶ИКұЈ¬Ca(OH)2өДИЬ¶И»эіЈКэKspјхРЎ
DЈ®КҜ»ТЛ®ПФјоРФЈ¬ДЬК№ө°°ЧЦКұдРФЈ¬ЛщТФУР·АЦОКчДҫІЎіжәҰөДЧчУГ
ІОҝјҙр°ёЈәA
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
3ЎўМоҝХМв ёщҫЭТФПВРЕПў»ШҙрПВБРОКМвЎЈ
ўс .СОјоөШЈЁә¬ҪП¶аNaClЎўNa2CO3Ј©І»АыУЪЧчОпЙъіЙЈ¬НЁ№эК©јУККБҝКҜёаЈЁCaSO4Ј©ҝЙТФҪөөННБИАөДјоРФЎЈ
.СОјоөШЈЁә¬ҪП¶аNaClЎўNa2CO3Ј©І»АыУЪЧчОпЙъіЙЈ¬НЁ№эК©јУККБҝКҜёаЈЁCaSO4Ј©ҝЙТФҪөөННБИАөДјоРФЎЈ
ўт.іӨЖЪК№УГөД№шВҜРиТӘ¶ЁЖЪіэЛ®№ёЈ¬·сФт»бҪөөНИјБПөДАыУГВКЎЈЛ®№ёЦРә¬УРөДCaSO4Ј¬ҝЙПИУГNa2CO3ИЬТәҙҰАнЈ¬К№Ц®ЧӘ»ҜОӘКиЛЙЎўТЧИЬУЪЛбөДCaCO3Ј¬¶шәуУГСОЛбіэИҘЎЈ
ўЩЗлУГАлЧУ·ҪіМКҪұнКҫСОјоөШІъЙъјоРФөДФӯТтЈә?Ј»
ўЪЗлУГ»ҜС§·ҪіМКҪұнКҫ јУИлКҜёаҪөөННБИАјоРФөД·ҙУҰФӯАн?Ј»
јУИлКҜёаҪөөННБИАјоРФөД·ҙУҰФӯАн?Ј»
ўЫЗлРҙіцЛ®№ёРьЧЗТәЦРCaSO4ИЬҪвЖҪәвөДАлЧУ·ҪіМКҪ?Ј»
ўЬ Зл·ЦОцЛ®№ёЦРөДCaSO4ЧӘ»ҜОӘCaCO3өДФӯАн?Ј»
Зл·ЦОцЛ®№ёЦРөДCaSO4ЧӘ»ҜОӘCaCO3өДФӯАн?Ј»
ўЭЗлРҙіцCaCO3ИЬУЪ№эБҝСОЛбөДАлЧУ·ҪіМКҪ?ЎЈ
ІОҝјҙр°ёЈәўЩCO32-+H2O 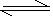 ?HCO3-+OH-, HCO3-+H2O
?HCO3-+OH-, HCO3-+H2O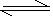 H2CO3+OH-
H2CO3+OH-
ўЪCaSO4+Na2CO3=CaCO3+ Na2SO4
ўЫ CaSO4(s) 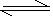 Ca2+(aq)+SO42-(aq)
Ca2+(aq)+SO42-(aq)
ўЬCaSO4өДіБөнИЬҪвЖҪәвЈ¬јУИлNa2CO3ИЬТәәуЈ¬CO32- УлCa2+ҪбәПЙъіЙёьДСИЬУЪЛ®өДCaCO3іБөнЈ¬Ca2+ЕЁ¶ИјхЙЩЈ¬К№CaSO4өДіБөнИЬҪвЖҪәвПтИЬҪв·ҪПтТЖ¶ҜЈ¬CaSO4іБөнјхЙЩЈ¬CaCO3іБөнЙъіЙЎЈ
ўЭCaCO3 +2H+= CO2Ўь+ H2O +Ca2+
ұҫМвҪвОцЈәВФ
ұҫМвДС¶ИЈәјтөҘ
4ЎўјЖЛгМв ЈЁ20·ЦЈ©ДСИЬ»ҜәПОпөДұҘәНИЬТәҙжФЪИЬҪвЖҪәв,АэИз:AgCl(s) Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s) 2Ag++
2Ag++ ЎЈФЪТ»¶ЁОВ¶ИПВ,ТСЦӘ:Ksp(AgCl)=c(Ag+)ЎӨc(Cl-)=1.8ЎБ10-10,Ksp(Ag2CrO4)=ЈЫc(Ag+)ЈЭ2ЎӨc(
ЎЈФЪТ»¶ЁОВ¶ИПВ,ТСЦӘ:Ksp(AgCl)=c(Ag+)ЎӨc(Cl-)=1.8ЎБ10-10,Ksp(Ag2CrO4)=ЈЫc(Ag+)ЈЭ2ЎӨc( )=1.9ЎБ10-12,ПЦУГ0.01 molЎӨL-1 AgNO3ИЬТәөО¶Ё0.01 molЎӨL-1 KClәН0.001 molЎӨL-1 K2CrO4»мәПИЬТә,НЁ№эјЖЛг»Шҙр:
)=1.9ЎБ10-12,ПЦУГ0.01 molЎӨL-1 AgNO3ИЬТәөО¶Ё0.01 molЎӨL-1 KClәН0.001 molЎӨL-1 K2CrO4»мәПИЬТә,НЁ№эјЖЛг»Шҙр:
(1)Cl-Ўў ЛӯПИіБөн?
ЛӯПИіБөн?
(2)өұёХіцПЦAg2CrO4іБөнКұ,ИЬТәЦРCl-өДОпЦКөДБҝЕЁ¶ИКЗ¶аЙЩ?(Йи»мәПИЬТәФЪ·ҙУҰЦРМе»эІ»ұд)
ІОҝјҙр°ёЈә(1)Cl-ПИіБөн? (2)4.13ЎБ10-6 molЎӨL-1
ұҫМвҪвОцЈә(1)ёщҫЭБҪЦЦОпЦКөДKsp,ЗуіцЙъіЙёчЧФөДіБөнЛщРиөДc(Ag+),ұИҪПБҪХЯc(Ag+),ЛӯРиc(Ag+)РЎЛӯПИіБөнЎЈ
іБөнCl-: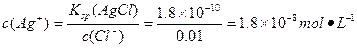 ЎЈ
ЎЈ
іБөн :
: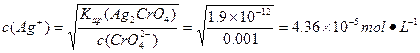 ЎЈ
ЎЈ
№КПИЙъіЙAgClіБөнЎЈ
(2)ТтЈЫc(Ag+)ЈЭ2ЎӨc( )=1.9ЎБ10-12,ЈЫc(Ag+)ЈЭ2ЎБ0.001 molЎӨL-1=1.9ЎБ10-12,c(Ag+)=4.36ЎБ10-5 molЎӨL-1,c(Ag+)ЎӨc(Cl-)=1.8ЎБ10-10,4.36ЎБ10-5ЎӨc(Cl-)=1.8ЎБ10-10,c(Cl-)=4.13ЎБ10-6 molЎӨL-1ЎЈ
)=1.9ЎБ10-12,ЈЫc(Ag+)ЈЭ2ЎБ0.001 molЎӨL-1=1.9ЎБ10-12,c(Ag+)=4.36ЎБ10-5 molЎӨL-1,c(Ag+)ЎӨc(Cl-)=1.8ЎБ10-10,4.36ЎБ10-5ЎӨc(Cl-)=1.8ЎБ10-10,c(Cl-)=4.13ЎБ10-6 molЎӨL-1ЎЈ
ұҫМвДС¶ИЈәјтөҘ
5ЎўСЎФсМв ПВБРРрКцЦРХэИ·өДКЗ? (ЎЎЎЎ)
AЈ®ИЬ¶И»эҙуөД»ҜәПОпИЬҪв¶ИТ»¶Ёҙу
BЈ®Птә¬УРAgCl№ММеөДИЬТәЦРјУИлККБҝөДЛ®К№AgClИЬҪвЈ¬УЦҙпөҪЖҪәвКұЈ¬AgClөДИЬҪв¶ИІ»ұдЈ¬ИЬ¶И»эТІІ»ұд
CЈ®Ҫ«ДСИЬөзҪвЦК·ЕИлҙҝЛ®ЦРЈ¬ИЬҪвҙпөҪЖҪәвКұЈ¬өзҪвЦКАлЧУөДЕЁ¶ИөДіЛ»эҫНКЗёГОпЦКөДИЬ¶И»э
DЈ®AgClЛ®ИЬТәөДөјөзРФәЬИхЈ¬ЛщТФAgClКЗИхөзҪвЦК
ІОҝјҙр°ёЈәB
ұҫМвҪвОцЈә¶ФУЪТхЎўСфАлЧУёцКэұИІ»Н¬өДөзҪвЦКАҙҪІЈ¬AПоРрКцКЗҙнОуөДЈ»ОВ¶ИТ»¶ЁКұЈ¬AgClөДИЬҪв¶ИәНИЬ¶И»э¶јТ»¶ЁЈ¬BХэИ·Ј»KspФЪКэЦөЙПөИУЪҙпөҪИЬҪвЖҪәвКұАлЧУЕЁ¶ИГЭЦ®»эЈ¬ІўІ»КЗАлЧУЕЁ¶ИөДіЛ»эЈ¬AgClКфУЪЗҝөзҪвЦКЈ¬CЎўDБҪПоҫщҙнЎЈ
ұҫМвДС¶ИЈәТ»°г