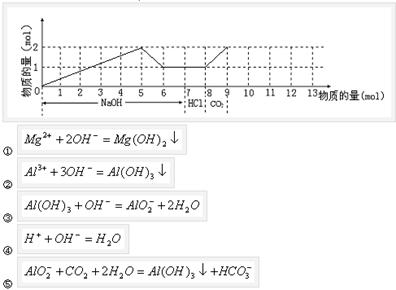
1、填空题 若含有1 mol M g2+和1 mol Al3+的混合溶液,现按下图横坐标依次加入7 mol NaOH溶液、1 mol盐酸,通入1 mol CO2气体,纵坐标为混合沉淀的物质的量。请画出沉淀的量随反应的变化曲线,并写出各步反应的离子方程式。
g2+和1 mol Al3+的混合溶液,现按下图横坐标依次加入7 mol NaOH溶液、1 mol盐酸,通入1 mol CO2气体,纵坐标为混合沉淀的物质的量。请画出沉淀的量随反应的变化曲线,并写出各步反应的离子方程式。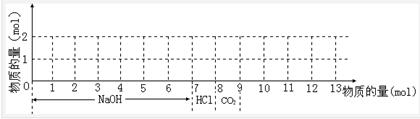
参考答案:
本题解析:略
本题难度:简单
2、选择题 下列离子方程式书写正确的是
[? ]
A.碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH==Ca2++2CH3COO-+2CO2↑+2H2O
B.FeI2溶液中通入少量的Cl2:2Fe2++CO2==2Fe3++2Cl-
C.饱和FeCl3溶液滴入沸水中:Fe3++3H2O Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-==BaCO3↓+2H2O+CO32-
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列化学方程式中,不能用离子方程式Ba2++SO42-==BaSO4↓表示的是
[? ]
A.Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
B.BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
C.BaCO3+H2SO4 = BaSO4↓ + H2O + CO2↑
D.BaCl2 + H2SO4 = BaSO4↓ + 2HCl
参考答案:C
本题解析:
本题难度:简单
4、填空题 (创新预测题)(1)①在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,这是因为________,离子方程式为__________________________。
②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,这是因为______________________________。离子方程式是_______________________________。
③对比①和②实验所得的结果,将I2、ClO-、SO42—性由强到弱的顺序排列为_____________________________。
(2)今有铁片、铜片,设计实验证明以下事实,并写出反应的化学方程式。
①浓硫酸的氧化性比稀硫酸强。________________________________。
②氯化铁溶液中Fe3+的氧化性比硫酸铜溶液中的Cu2+强。__________________________。
③铁的还原性比铜强。
___________________________________________________________。
参考答案:(1)①NaClO将KI氧化生成了I2
ClO-+2I-+H2O=I2+Cl-+2OH-
②I2被Na2SO3还原生成了
SO32—+2OH-=SO42—-+H2O
③ClO->I2>SO42—
(2)①Cu与浓硫酸反应而与稀硫酸不反应。
Cu+2H2SO4(浓)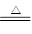 ?+SO2↑+2H2O
?+SO2↑+2H2O
②Cu能与FeCl3溶液反应,
2FeCl3+Cu=2FeCl2+CuCl2
③Fe能与CuSO4溶液反应置换出Cu,
Fe+CuSO4=FeSO4+Cu(答案不唯一,合理即可)
本题解析:(1)利用淀粉遇I2变蓝的特性验证NaClO的氧化性和Na2SO3的还原性,书写化学方程式时注意溶液环境为碱性。(2)列举常见反应事实即可。
本题难度:一般
5、选择题 下列离子方程式表示正确的是( )
A.AgNO3溶液中加入Cu:Cu+Ag+═Cu2++Ag
B.NaHCO3溶液中加入CH3COOH:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
C.0.1mol FeBr2 溶液中通入足量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
参考答案:A.反应前后离子所带的电荷不守恒,正确的离子方程式为Cu+2Ag+═Cu2++2Ag,故A错误;
B.HCO3-是弱酸的酸式根,不能拆开,正确的离子方程式为HCO3-+CH3COOH=CO2↑+CH3COO-+H2O,故B错误;
C.通入足量氯气时,Fe2+和Br-的计量数之比应为1:2,应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C错误;
D.体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合,HCO3-完全反应生成BaCO3,反应的离子方程式为HCO3-+Ba2++OH-=BaCO3↓+H2O,故D正确.
故选D.
本题解析:
本题难度:简单