|
高考化学知识点总结《难溶电解质的溶解平衡》考点预测(2019年强化版)(十)
2019-03-14 23:01:55
【 大 中 小】
|
1、选择题 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s)

Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)?c(Cl-),称为溶度积常数;又知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是( )
A.加入NaCl可以使溶液由a点变到b点
B.b点和d点均无AgCl沉淀生成
C.a点对应的Ksp大于c点对应的Ksp
D.向0.1mol/L的硝酸银溶液中滴加0.1mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀.其沉淀转化的反应方程式为:2AgCl(s)+S2-(aq)

Ag2S(s)+2Cl-(aq)
| 
参考答案:A.加入NaCl,Cl-浓度增大,Ag+浓度减小,而a点与b点Cl-浓度相同,故A错误;
B.b点c(Ag+)?c(Cl-)>Ksp,有沉淀生成,d点c(Ag+)?c(Cl-)<Ksp,没有沉淀生成,故B错误;
C.a点和c点处于相同温度下,Ksp相同,故C错误;
D.Ag2S溶度积较小,较AgCl难溶,在AgCl饱和溶液中加入Na2S溶液,白色沉淀转化为黑色沉淀,故D正确.
故选D.
本题解析:
本题难度:一般
2、简答题 (1)向2.0mL浓度为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp______(填“小”或“大”).
(2)医药级二水合氯化钙(CaCl2?2H2O)样品中Cl-含量的测定方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值是20.39mL.
①上述测定过程中需用溶液润洗的仪器是______,如果在测定前没有润洗该仪器,测定结果(质量分数)会
______(选填“偏大”、“偏小”或“无影响”).
②计算上述样品中CaCl2?2H2O的质量分数.
参考答案:(1)在溶液中溶度积小的沉淀先析出,已知向2.0mL浓度为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/LAgNO3溶液,振荡,沉淀呈黄色,说明先生成AgI,所以AgI的溶解度小,即AgCl的Ksp比AgI的Ksp大;故答案为:大;
(2)①标准溶液为硝酸银溶液,所以用酸式滴定管盛放,在使用前应先用硝酸银溶液进行润洗;若没有润洗该仪器,则硝酸银浓度减小,滴定时消耗的硝酸银的体积偏大,根据c(未知)=c(已知)?c(已知)V(未知),可知测定结果会偏大;
故答案为:酸式滴定管;偏大;
②已知称取0.7500g样品,溶解,在250mL容量瓶中定容,量取25.00mL待测溶液于锥形瓶中,所以样品中n(Cl-)=0.05000mol?L-1×0.02039L×10=0.010195mol,根据n(AgCl)=2n(CaCl2?2H2O),则n(CaCl2?2H2O)=0.0050975mol,所以m(CaCl2?2H2O)=0.0050975mol×147g/mol=0.7493325g,
则有:0.74933250.7500×100%=99.9%,
答:样品中CaCl2?2H2O的质量分数为99.9%.
本题解析:
本题难度:一般
3、选择题 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀
[? ]
A.溶解
B.增多
C.不变
D.无法判断
参考答案:A
本题解析:
本题难度:一般
4、填空题 (16分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
| 开始沉淀
| 2.3
| 7.5
| 3.4
| 完全沉淀
| 3.2
| 9.7
| 4.4
|
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 ,发生反应的离子方程式为 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
参考答案:(1)4.4~7.5 (2分) Al3+ (2分)
(2)氧化Fe2+(2分) 2H+ + Fe2++ NO2- = Fe3+ + NO↑+ H2O (3分)
(3)2 mol (2分) (4)2Fe(OH)2+ +2H2O Fe2(OH)42+ + 2H+ (3分) (5)D (2分) Fe2(OH)42+ + 2H+ (3分) (5)D (2分)
本题解析:(1)制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH使溶液中的Al3+生成Al(OH)3沉淀,同时要避免生成应Fe(OH)2沉淀,控制pH在4.4≤pH<7.5之间;
(2)亚硝酸盐具有氧化性,在酸性条件下能把亚铁离子氧化生成铁离子,反应的离子方程式为2H+ + Fe2++ NO2- =Fe3+ + NO↑+ H2O;
(3)氧气的物质的量是11.2L÷22.4L/mol=0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要2molNaNO2;
(4)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2Fe(OH)2+ +2H2O Fe2(OH)42+ + 2H+; Fe2(OH)42+ + 2H+;
(5)A、氯水可以氧化亚铁离子为铁离子,溶液颜色变化不明显,不能检验亚铁离子,故A不符合;B、KSCN溶液和亚铁离子不反应,无现象发生,故B不符合;C、NaOH溶液加入和铁离子反应生成红褐色沉淀不能检验是否存在亚铁离子,故C不符合;D、酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色,故D符合,答案选D。
考点:考查物质制备工艺流程图的有关判断与计算
本题难度:困难
5、填空题 (10分 )工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
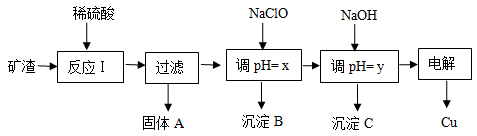
已知: Cu2O + 2H+ =" Cu" + Cu2+ + H2O
沉淀物
| Cu(OH)2
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| 开始沉淀pH
| 5.4
| 4.0
| 1.1
| 5.8
| 沉淀完全pH
| 6.7
| 5.2
| 3.2
| 8.8
|
(1)反应I中如果Cu2O与Fe2O3之间恰好发生氧化还原反应,则反应的化学方程式为:___________________________________________________________________________
(2)用NaClO调pH=x是此工艺流程中的最佳选择。
①选择NaClO的理由是:____________________________________________________
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
_________________________________________________________________________
(3)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol·L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为 ____。(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(4)电解初期阳极的电极反应式为________________________________
参考答案:(10分,每空2分)
(1)Cu2O + Fe2O3 + 4H2SO4= 2CuSO4 + 2FeSO4 + 4H2O
(2)①NaClO由于发生反应ClO-+ H+ HClO,ClO-消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+。所以最好用NaClO调节pH。 HClO,ClO-消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+。所以最好用NaClO调节pH。
②5ClO-+ 2Fe2+ + 5H2O = 2Fe(OH)3 + Cl-+ 4HClO
(或 2Fe2+ +7ClO-+ 2H++ 5H2O = 2Fe(OH)3 + Cl-+ 6HClO)
(3)6 (4)2Cl-- 2e- = Cl2↑
本题解析:(1)Cu2O与Fe2O3之间恰好发生氧化还原反应,+3价的Fe把+1价的Cu氧化为+2价,根据化合价升降法配平可得化学方程式:Cu2O + Fe2O3 + 4H2SO4= 2CuSO4 + 2FeSO4 + 4H2O
(2)①ClO?能与H+反应:ClO-+ H+ HClO,消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+,所以最好用NaClO调节pH。 HClO,消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+,所以最好用NaClO调节pH。
②NaClO有氧化性,Fe2+有还原性。所以用NaClO调节pH,生成沉淀B为Fe(OH)3,同时生成一种具有漂白作用的物质为HClO,该反应的离子方程式为5ClO-+ 2Fe2+ + 5H2O = 2Fe(OH)3 + Cl-+ 4HClO或2Fe2++7ClO-+2H++5H2O=2Fe(OH)3↓+Cl-+6HClO。
(3)溶液中Cu2+浓度降至原来的百分之一,为2×10-4mol?L?1,根据c(Cu2+)?c2(OH?)==2×10-20,解得c(OH?)=1×10、8mol/L,则pH=6。
(4)电解初期阳极上Cl?失电子,所以电极反应式为:2Cl-- 2e- = Cl2↑
考点:本题考查化学流程的分析、方程式的书写、溶度积的计算、电解原理。
本题难度:困难
| 