1、选择题
A.3种
B.6种
C.9种
D.12种
参考答案:C
本题解析:从水分子的原子组成来看,每个H原子分别与16O、17O、18O形成H216O、H217O、H218O等3种分子;同理每个D原子分别与三种氧原子形成D216O、D217O、D218O等3种分子;而H、D两原子也可分别与三种氧原子形成H16OD、H17OD、H18OD等3种分子;故自然界的水一共有9种。
本题难度:简单
2、选择题 amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为?(?)
A.(a+3b)mol
B.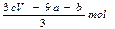
C.
D.(cV-3a-9b)mol
参考答案:B
本题解析:略
本题难度:一般
3、选择题 下列关于碱金属的叙述正确的是
[? ]
A.钾与氧气或水反应比钠的反应剧烈,铷、铯的反应更剧烈
B.碱金属的密度随着原子序数的递增逐渐减小
C.碱金属元素的最高价氧化物对应的水化物的碱性随着原子序数的递增依次增强
D.碱金属元素的阳离子的氧化性随着原子序数的递增依次增强
参考答案:AC
本题解析:
本题难度:一般
4、简答题 Al和Ga及N和As分别是同主族的元素,请回答下列问题:
(1)砷化镓是一种半导体材料,其化学式为______.
(2)写出As原子处于基态时的核外电子排布式______.
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与______个氮原子相连,氮化铝晶体属于______晶体.
(4)NH3是氮的氢化物,中心原子的杂化方式是______,存在化学键的类型是______,NH3的沸点比AsH3高的原因是______.
参考答案:(1)砷元素位于第ⅤA族,所以最低负价是-3价,镓元素元素处于第ⅢA族,最高正价是+3价,根据化合价规则,所以砷化镓的化学式为:GaAs,故答案为:GaAs;
(2)根据基态电子排布规律,As原子的基态电子排布式为:1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(3)氮化铝晶体与金刚石类似,均是正四面体结构,每个铝原子与4个氮原子相连,是由原子构成的原子晶体,故答案为:4;原子;
(4)氨气是空间三角锥形结构,氮原子以sp3杂化成键,形成空间三角锥形结构,氮原子和氢原子间是共价键,在氨气分子中,存在氢键,所以导致沸点高于同主族的其他氢化物,故答案为:sp3;共价键;氨气分子间有氢键.
本题解析:
本题难度:一般
5、选择题 下列各组元素性质递变规律不正确的是( )
A.Li、Be、B原子半径依次减小
B.PH3、H2S、HCl还原性依次减弱
C.N、O、F的氢化物稳定性依减弱
D.NaOH、KOH、RbOH的碱性依次增强
参考答案:A.Li、Be、B位于周期表相同周期,原子序数逐渐增大,半径逐渐减小,故A正确;
B.非金属性:P<S<Cl,元素的非金属性越强,对应的氢化物的还原性越弱,则PH3、H2S、HCl还原性依次减弱,故B正确;
C.非金属性:N<O<F,元素的非金属性越强,对应的氢化物越稳定,则N、O、F的氢化物稳定性依增强,故C错误;
D.金属性:Na<K<Rb,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则NaOH、KOH、RbOH的碱性依次增强,故D正确.
故选C.
本题解析:
本题难度:一般