1、选择题 在pH=1的无色透明溶液中不能大量共存的离子组是
A.Al3+Ag+NO3-Cl-
B.Mg2+NH4+NO3-Cl-
C.Ba2+K+S2-Cl-
D.Zn2+Na+NO3-SO42-
参考答案:AC
本题解析:分析:pH=1的溶液中含有大量的H+,利用离子之间不能结合生成沉淀、弱电解质等来判断离子的共存.
解答:A、因在酸性溶液中,Ag+、Cl-结合生成氯化银沉淀,则不能大量共存,故A选;
B、因该组离子之间不反应,则能够大量共存,故B不选;
C、因酸性溶液中,H+、S2-结合生成弱电解质H2S,则不能大量共存,故C选;
D、因该组离子之间不反应,则能够大量共存,故D不选;
故选AC.
点评:本题较简单,考查离子的共存问题,明确常见物质的溶解性、强弱电解质是解答本题的关键,并注意利用pH来分析溶液中的离子来解答.
本题难度:一般
2、选择题 某气体混合物中可能含有SO2、N2、CO2,检查其中是否含有CO2的正确方法是
A.用燃烧木条检查是否使火焰熄灭
B.使混合气体先通过酸性高锰酸钾溶液,再通入澄清石灰水
C.使混合气体通过NaOH溶液,再通入澄清石灰水
D.使混合气体通过Na2=CO3,溶液,再通入澄清石灰水
参考答案:B
本题解析:
本题难度:困难
3、选择题 某溶液中存在大量的Al3+、H+、SO42-,则该溶液中还可能大量存在的离子是
A.OH-
B.Ba2+
C.NO3-
D.ClO-
参考答案:C
本题解析:分析:根据离子之间不能结合生成水、气体、沉淀、弱电解质等,则能大量共存,以此来解答.
解答:A.因OH-、H+结合生成水,则不能共存,故A错误;
B.因Ba2+、SO42-结合生成沉淀,则不能共存,故B错误;
C.因该组离子之间不反应,能共存,故C正确;
D.因H+、ClO-结合生成弱电解质,则不能共存,故D错误;
故选C.
点评:本题考查离子的共存,熟悉复分解反应发生的条件即可解答,注重基础知识的考查,题目较简单.
本题难度:困难
4、选择题 短周期元素R的原子核外电子数等于核内中子数,该元素单质7.8g与氧气充分反应可生成13g化合物RO,则该元素的价电子层是
A.1S2
B.2S2
C.3S2
D.4S2
参考答案:C
本题解析:根据化学式可知R的化合价是+2价。根据原子守恒可知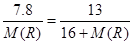 ,解得M(R)=24. R的原子核外电子数等于核内中子数,所以原子序数为12,即为镁元素。大选C。
,解得M(R)=24. R的原子核外电子数等于核内中子数,所以原子序数为12,即为镁元素。大选C。
本题难度:困难
5、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.1mol/L氢氰酸溶液的pH约为5
B.HCN易溶于水
C.10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应
D.在相同条件下,HCN溶液的导电性比盐酸溶液弱
参考答案:AD
本题解析:分析:氢氰酸为弱电解质,则利用其电离不完全来分析,一般测定溶液的pH或测定相同条件下与强酸的导电性比较来判断.
解答:A、氢氰酸为一元酸,1mol/L氢氰酸溶液的pH=0时该酸为强酸,但pH约为5,说明电离生成的氢离子约为10-5mol/L<
1mol/L,电离不完全,故A正确;
B、不能利用物质的溶解性来判断是否为弱电解质,即溶解性与电解质的强弱无关,故B错误;
C、10mL1mol/LHCN恰好与10mL1mol/LNaOH溶液完全反应,只能说明HCN为酸,不能说明其电离的程度,故C错误;
D、HCl为一元强酸,在相同条件下,HCN溶液的导电性比盐酸溶液弱,则说明HCN电离不完全,故D正确;
故选AD.
点评:本题考查弱电解质的判断方法,明确弱电解质在水中电离不完全是解答本题的关键,学生应注意在平时的学习中归纳判断弱电解质的方法,难度不大.
本题难度:一般