1、选择题 下列实验能达到目的是
A.用溴水鉴别苯和正已烷
B.用BaCl2溶液鉴别SO42-与SO32-
C.用浓HNO3与Cu反应制备NO2
D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl
参考答案:C
本题解析:分析:A.苯和正已烷都不溶于水,且密度比水小;
B.都生成沉淀;
C.浓HNO3与Cu反应生成NO2;
D.引入新的杂质.
解答:A.两者密度都比水小,均发生萃取,溴水层褪色,不能鉴别,故A错误;
B.两者都有沉淀生成,不能鉴别,故B错误;
C.浓硝酸具有强氧化性,可与Cu反应生成NO2,故C正确;
D.两者均能与NaHCO3溶液反应,而且引入CO2,故D错误.
故选C.
点评:本题考查元素化合物知识,题目难度不大,注意把握物质的性质的异同,鉴别物质时,应能产生不同的反应现象.
本题难度:简单
2、选择题 下列说法中正确的是
A.分子中键能越高,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间通常不能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.根据等电子原理,CH4和NH3具有相似的化学键特征,物理性质相近。
参考答案:B
本题解析:
本题难度:困难
3、选择题 下列反应的离子方程式正确的是
A.氯化亚铁溶液中加入氯水:Fe2++Cl2=2Cl-+Fe3+
B.烧碱溶液腐蚀毛玻璃:SiO2+2OH-=SiO32-+H2O
C.钠与水反应:Na+H2O=Na++H2↑+OH-
D.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
参考答案:B
本题解析:分析:A、电子转移不守恒、电荷不守恒.
B、二氧化硅与氢氧化钠反应生成硅酸钠与水,氢氧化钠与硅酸钠写成离子形式,二氧化硅与水写成化学式.
C、电子转移不守恒.
D、次氯酸是弱电解质,应写成化学式.
解答:A、电子转移不守恒、电荷不守恒,应为2Fe2++Cl2=2Cl-+2Fe3+,故A错误;
B、二氧化硅与氢氧化钠反应生成硅酸钠与水,氢氧化钠为强碱、硅酸钠为可溶性盐应写成离子形式,二氧化硅与水是氧化物应写成化学式,离子方程式为SiO2+2OH-=SiO32-+H2O,故B正确;
C、电子转移不守恒,离子方程式应为2Na+2H2O=2Na++H2↑+2OH-,故C错误;
D、次氯酸是弱电解质,应写成化学式,离子方程式应为Cl2+H2O=H++Cl-+HClO,故D错误.
故选:B.
点评:考查离子方程式的书写与正误判断,难度中等,是对学生综合能力与所学知识运用的考查,掌握元素化合物知识与离子方程式的书写与判断方法. 判断离子方程式书写正误的方法:
(1)看离子反应是还符合客观事实,不事主观臆造产物及反应.
(2)看“=”、“?”“↓”“↑”等是否正确.
(3)看表示各物质的化学式是否正确.如HCO3-不能写成 CO32-+H+等
(4)看是否漏掉离子反应.如Ba(OH)2 溶液与CuSO4 溶液反应,既要写Ba2+与SO42-的离子反应,又要写Cu2+与OH-的离子反应.
(5)看电荷是否守恒.
(6)看反应物与产物的配比是否正确.如稀H2SO4 与Ba(OH)2 溶液反应不能写成 H++OH-+SO42-+Ba2+═BaSO4↓+H2O,应写成2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O.
(7)看是否符合题设条件及要求.如“过量““少量““等物质的量““适量““任意量以““滴加顺序“对反应方式或产物的影响.
本题难度:困难
4、选择题 X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次内层电子数的3倍,下列说法正确的是
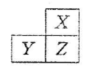
A.原子半径: Y >Z >X
B.气态氢化物的热稳定性:XC.Y和Z的最高价氧化物对应水化物均为强酸
D.若Z的最高正价为+m
E.则X的最高正价也一定为+m
参考答案:A
本题解析:X原子的最外层电子数是其次内层电子数的3倍,X为氧,则根据其在周期表的位置,Z为硫,Y为磷。同周期原子半径越往右越小,同主族原子半径越往下越大,故A对。同主族元素,越往上非金属性越强,气态氢化物越稳定,B错。磷酸不是强酸,C错。硫的最高价为+6,但氧的最高价不是+6,D错。
本题难度:一般
5、选择题 下列物质分子中一定含有π键的是
A.HCl
B.H2O2
C.CH2Cl2
D.N2
参考答案:D
本题解析:A.HCl? H-Cl;B.H2O2 ?H-O-O-H;C.CH2Cl2,类似于甲烷,全为单键;
D.N2 N≡N, 含有两个π键
本题难度:困难