1、选择题 把铁粉放入氯化铜和氯化铁的混合溶液中,充分反应后,铁粉全部溶解。由此可判断下列说法正确的是
A.若无铜析出,溶液中有Cu2+、Fe2+和Fe3+离子
B.若无铜析出,溶液中有Cu2+和Fe2+离子,也可能有Fe3+离子
C.若有铜析出,溶液中有Fe2+离子,没有Cu2+和Fe3+离子
D.若有铜析出,溶液中有Fe2+离子,可能有Cu2+离子,也可能有Fe3+离子
参考答案:B
本题解析:铁可依次与Fe3+、Cu2+发生离子反应:①Fe+2Fe3+=3Fe2+② Fe+Cu2+=Cu+Fe2+
若无铜析出,说明反应①可能全部进行或部分进行,反应②没有发生,即A不正确,B正确
若有铜析出,则反应①已全部进行,反应②可能部分进行,也可能恰好完全反应,溶液中有Fe2+离子,可能有Cu2+离子,但绝对不可能有Fe3+离子,排除CD
答案为B
本题难度:一般
2、简答题 铝、铁两种金属的单质及其化合物在生产、生活中有着广泛的应用.请回答:
(1)两种金属对应的氧化物中,具有两性的物质是(填化学式)______,其与NaOH溶液反应生成的盐是(填化学式)______.
(2)向FeCl3溶液中滴入KSCN溶液,可以观察到的现象是(填序号)______.
①产生红色沉淀②形成红色溶液
(3)将氢氧化亚铁浊液置于空气中,观察到白色沉淀迅速变为灰绿色,最后变为红褐色,写出反应的化学方程式______.
参考答案:(1)铝、铁两种金属的单质对应的氧化物中,具有两性的物质是氧化铝Al2O3,具有两性能和强酸强碱反应,与氢氧化钠溶液反应生成的盐是偏铝酸钠NaAlO2;
故答案为:Al2O3;NaAlO2;
(2)向FeCl3溶液中滴入KSCN溶液,可以观察到的现象是形成红色溶液,反应离子方程式为Fe3++3SCN-=Fe(SCN)3;
故答案为:②;
(3)将氢氧化亚铁浊液置于空气中,观察到白色沉淀迅速变为灰绿色,最后变为红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4 Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
本题解析:
本题难度:一般
3、填空题 (15分)铁及其化合物在国民经济、日常生活中占有非常 重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
(1)铁在自然界中以?态存在,其氧化物呈黑色的是?,呈红褐色的是?(填写化学式)。
(2)铁在纯氧气中燃烧的化学方程式为?。
铁在氯气中反应的产物是?。
(3)要验证一种溶液中是否含有Fe3+、Fe2+,正确的实验方法是?。
A.向甲试管中 加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
B.向乙试管中加入试液,滴入氯水,若氯水褪色,证明一定存在Fe2+。
C.向丙试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中一定存在Fe3+
(4)铁合金有下列数据:
钢
|
碳素钢(Fe、C、Mn、Si)
| 合金钢
|
低碳钢
| 中碳钢
| 高碳钢
| 碳素钢+Cr、Mn、W、Ni、Co等
|
含碳量<0.3%
| 含碳量0.3%--0.6%
| 含碳量>0.6%
|
韧性好,强度低
| 韧性好、强度好
| 硬而脆
| 具有特殊性能
|
取15g某碳素钢样品,按下列实验流程进行操作:
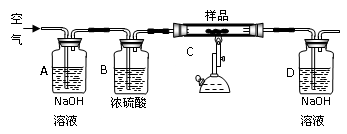
①A、B的作用是?,
②充分加热完全反应后,D装置质量增加0.022g,该样品属于?钢。
③没有A、B装置,实验结果?(填“偏高”“偏低”“不影响”)
参考答案:(13分)
(1)游离态、化合,?FeO、Fe3O4,?Fe2O3?(各1分=3分)
(2)3Fe+2O2  Fe3O4?(2分)?
Fe3O4?(2分)?
FeCl3?(1分)
(3)AB? (2分)
(4)①除去空气中的二氧化碳和水蒸气? (2分)
②中碳? (2分)?
③偏高? (1分)
本题解析:略
本题难度:简单
4、计算题 将适量的铁粉加入FeCl3溶液中,充分反应后,溶液中的Fe3+和Fe2+浓度相等,则加入的铁粉和原来的FeCl3物质的量之比为多少
参考答案:设参加反应的铁的物质的量是x,原FeCl3物质的量是y,则
Fe+2Fe3+=3Fe2+
1? 2? 3
x? 2x? 3x
所以有3x=y-2x
解得x︰y=1︰5
本题解析:考查根据方程式进行的有关计算。
本题难度:一般
5、填空题 上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
A.稀硫酸
B.氨水
C.氢氧化钠溶液
D.高锰酸钾溶液