|
高中化学知识点讲解《金属的腐蚀与防护》高频考点强化练习(2019年最新版)(十)
2019-03-14 23:08:28
【 大 中 小】
|
1、选择题 某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图所示的装置进行实验,过一段时间后观察.下列现象不?可能出现的是( )
A.B中导气管产生气泡
B.B中导气管里形成一段水柱
C.金属片剪口变红
D.锌被腐蚀
| 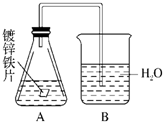
参考答案:镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,形成的原电池中,金属锌为负极,发生反应:Zn-2e-=Zn2+,铁为正极,发生吸氧腐蚀,即2H2O+O2+4e-=4OH-,所以锥形瓶中气体压强减小,生成的氢氧根离子遇到酚酞会显示红色.
A、原电池形成后没有气体生成,所以B中导气管不会产生气泡,故A错误;
B、锥形瓶中金属发生吸氧腐蚀,瓶中气体压强减小,导气管里形成一段水柱,故B正确;
C、锥形瓶中金属发生吸氧腐蚀,生成的氢氧根离子遇到酚酞会显示红色,故C正确;
D、形成的原电池中,金属锌为负极,发生反应:Zn-2e-=Zn2+,故D正确.
故选A.
本题解析:
本题难度:一般
2、填空题 (9分)认真观察下列装置,回答下列问题:
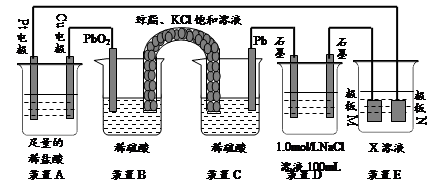
⑴装置B中PbO2上发生的电极反应方程式为?。
⑵装置A中总反应的离子方程式为?。
⑶若装置E中的目的是在Cu材料上镀银,则X为?,极板N的材料为?。
若装置E的目的是验证金属的电化学防腐,则极板N的材料为__________________ 。
⑷当装置A中Cu电极质量改变6?.4g时,装置D中产生的气体体积为?L(标准状况下)。
参考答案:⑴PbO2+4H++SO2- 4+2e-=PbSO4+2H2O (2分)?
⑵Cu+2H+ Cu2++H2↑(2分) Cu2++H2↑(2分)
⑶AgNO3? Ag?惰性电极(或石墨等不溶性惰性材料)(各1分)?⑷3.92(2分)
本题解析:(1)根据装置图可判断,BC是原电池,二氧化铅是正极,得到电子,电极反应式为PbO2+4H++SO2- 4+2e-=PbSO4+2H2O。
(2)A中铜电极和正极相连,是阳极,铜失去电子。阴极是Pt,溶液中的氢离子得到电子,所以总的反应式为Cu+2H+ Cu2++H2↑。 Cu2++H2↑。
(3)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,所以X是硝酸银溶液。N是阳极,则N是银。由于N是阳极,所以如果装置E的目的是验证金属的电化学防腐,则极板N的材料应为惰性电极。
(4)当装置A中Cu电极质量改变6?.4g时,转移电子是6.4g÷64g/mol×2=0.2mol。装置D中氯化钠是0.1mol,阴极是氢离子放电,氢气是0.1mol。阳极是氯离子放电,生成氯气,物质的量是0.05mol,所以阴极还生成氧气,物质的量是0.1mol÷4=0.025mol,
所以标准状况下的体积共计是(0.1mol+0.05mol+0.025mol)×22.4L/mol=3.92L.。
本题难度:一般
3、填空题 (14分)某课外活动小组同学用图一装置进行实验,试回答下列问题。
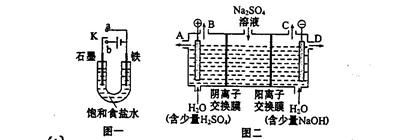
(1)① 若开始时开关K与a连接,则铁发生的是电化学腐蚀中的?腐蚀;
② 若开始时开关K与b连接,则总反应的离子方程式?。
(2)芒硝(化学式为Na2SO4·10H2O),无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法。用如图二所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率来看都更加符合绿色化学理念。
① 该电解槽的阳极反应式为:?,此时通过阴离子交换膜的离子数?(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
② 制得的氢氧化钠溶液从出口(选填“A”、“B”、“C”、“D”)?导出。
③ 若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为?。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有?kJ的能量转化为电能。
参考答案:(1)① 吸氧?② 2Cl— +2H2O 2OH— + H2↑+ Cl2↑ 2OH— + H2↑+ Cl2↑
(2)① 4OH—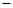 4e—=2H2O + O2↑?小于?② D?③ H2 4e—=2H2O + O2↑?小于?② D?③ H2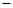 2e—+ 2OH—=2H2O? 571.6 2e—+ 2OH—=2H2O? 571.6
本题解析:(1)① 若开始时开关K与a连接,则构成原电池,由于溶液显中性,所以发生钢铁的吸氧腐蚀。
②若开始时开关K与b连接,则构成电解池,石墨和电源的正极相连,作阳极,溶液中的氯离子放电。铁和电源的负极相连,作阴极,溶液中的氢离子放电,所以方程式为2Cl— +2H2O 2OH— + H2↑+ Cl2↑。 2OH— + H2↑+ Cl2↑。
(2)①电解池中阳极失去电子,则溶液中的OH-失去电子,方程式为 4OH—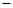 4e—=2H2O + O2↑。由于通过阴离子交换膜的是SO42-,而通过阳离子交换膜的是H+,所以根据电荷守恒可知,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数。 4e—=2H2O + O2↑。由于通过阴离子交换膜的是SO42-,而通过阳离子交换膜的是H+,所以根据电荷守恒可知,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数。
②氢氧化钠在阴极生成,所以从D处导出。
③原电池中负极失去电子,正极得到电子,所以氢气在负极通入。由于溶液是氢氧化钠溶液,因此负极电极反应式为H2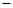 2e—+ 2OH—=2H2O。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以生成36g水放出的热量是285.8 kJ×2=571.6kJ,即有571.6kJ的能量转化为电能。 2e—+ 2OH—=2H2O。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以生成36g水放出的热量是285.8 kJ×2=571.6kJ,即有571.6kJ的能量转化为电能。
本题难度:一般
4、选择题 如图各装置中均盛有海水,铁在其中被腐蚀由快到慢的顺序正确的是( )
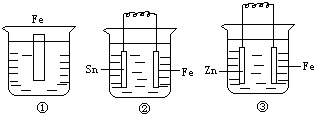
A.①>②>③
B.②>①>③
C.③>②>①
D.②>③>①
参考答案:②装置中铁作负极,很容易失电子变成离子进入溶液,所以促进铁腐蚀的速度;
③装置铁作正极,锌易失电子而使铁受到保护,抑制铁腐蚀的速度;
③装置铁受到保护,①装置铁的反应速度未受到保护也未受到抑制,所以①中铁的腐蚀比③中的快.
所以:铁在其中被腐蚀由快到慢的顺序为②>①>③.
故选B.
本题解析:
本题难度:简单
5、选择题 下图为某太空站的能量转化示意图,其中燃料电池用KOH溶液为电解液。下列说法不正确的是。
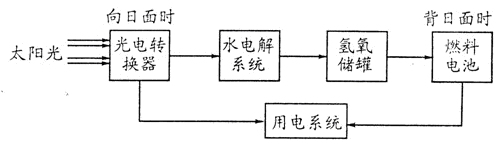
A.水电解系统中,加入Na2 SO4可增加溶液导电性
B.燃料电池的负极反应:H2+2OH一一2 e一="2" H2O
C.整个系统实现了物质零排放及能量间完全转化
D.该系统发生总反应:2H2+O2  2 H2O 2 H2O
参考答案:C
本题解析:A、纯水导电性不强,在水电解系统中,加入Na2 SO4可增加溶液导电性;B、碱性燃料电池的
负极反应:H2+2OH一一2 e一="2" H2O;C、电解过程当中,燃料电池的效率不可能达到100%;整个系
统实现了物质零排放及能量间并不能完全转化。? D、该系统发生总反应就是:2H2+O2  2 H2O。 2 H2O。
本题难度:一般
| 