1、选择题 为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在下图所 的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象描述不正确的是

[? ]
A.装置I左侧的液面一定会下降
B.装置Ⅱ中的铁钉腐蚀最快
C.装置Ⅲ中的铁钉几乎没有被腐蚀
D.装置I中的铁丝和装置Ⅱ中的铜丝都会被腐蚀
参考答案:D
本题解析:
本题难度:一般
2、选择题 表面镀有保护金属层的铁片,当镀层有破损时比普通铁片更易腐蚀的是( )
A.白铁(镀锌铁)
B.马口铁(镀锡铁)
C.镀铅铁
D.镀铜铁
参考答案:A、镀锌铁中,金属铁作正极,是被保护的电极,比普通铁片更耐腐蚀,故A错误;
B、镀锡铁中,金属铁作负极,是被腐蚀的电极,比普通铁片更易腐蚀,故B正确;
C、镀铅铁中,金属铁作正极,是被保护的电极,比普通铁片更耐腐蚀,故C错误;
D、镀铜铁中,金属铁作负极,是被腐蚀的电极,比普通铁片更易腐蚀,故D正确;
故选BD.
本题解析:
本题难度:一般
3、填空题 (8分)对照试验是化学研究中常用的一种方法。某研究小组对铁生锈进行如下研究。
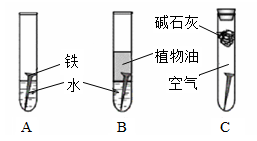
(1)经过较长时间后发现:上述图中的铁钉最容易生锈的是?。
(2)在铁钉的锈蚀过程中,Fe发生了?(填“氧化”或“还原”)反应。
(3)铁生锈的外部条件是?。
(4)钢铁工业史国家工业的基础。下列措施能起到防腐作用的是?。
A.刷油漆?B.包上一层塑料层?C.连接一定数量镁块
参考答案:(8分)(1)A?(2)氧化?(3)与空气、水充分接触?(4)ABC
本题解析:(1)植物油可以隔绝空气,减缓铁的腐蚀。碱石灰可以吸水,减缓铁的腐蚀,所以腐蚀最快的是A。
(2)铁失去电子被腐蚀,主要是发生了氧化反应。
(3)在潮湿的空气中铁容易生锈,所以铁生锈的外部条件是与空气、水充分接触。
(4)AB可以隔绝空气,防止腐蚀。C中镁的金属性强于铁,发生电化学腐蚀时镁是负极,铁是正极,被保护,所以答案选ABC。
点评:该题是中等难度的试题,试题贴近高考,难易适中。在注重对基础性知识巩固与训练的同时,侧重对学生能力的培养,有助于调动学生的学习兴趣和学习积极性,也有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:简单
4、选择题 被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。总反应的化学方程式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是(?)
A.电池工作时,锌失去电子
B.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
C.电池工作时,电子由正极通过外电路流向负极
D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH-
参考答案:C
本题解析:在纸质电池中镀锌一边为负极,镀二氧化锰一边为正极。电池工作时A.电池工作时,锌失去电子产生的Zn2+与OH-结合产生Zn(OH)2。正确。B.由方程式可看出:1摩尔Zn反应,转移电子2摩尔。即外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g。正确。C电池工作时,电子由负极通过外电路流向正极。错误。D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH-,负极的电极反应式为:Zn-2e-+2OH -= Zn(OH)2.正确。
本题难度:一般
5、选择题 镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。其中一种镁电池的反应原理为: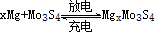 ,下列说法不正确的是(?)
,下列说法不正确的是(?)
A.放电时,正极反应式:Mo3S4+2xe- =Mo3S42x-
B.放电时,Mo3S4发生氧化反应
C.充电时,Mg2+向阴极迁移
D.充电时,阴极反应式:xMg2++2xe-=xMg
参考答案:B
本题解析:放电时,正极为还原反应, A正确;放电时Mo3S4中Mo的化合价降低,所以发生还原反应,B错误;充电时阳离子向阴极移动,C正确;充电时阴极发生还原反应,D正确。答案选B。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。
本题难度:一般