1、选择题 下列有关钢材生锈的说法正确的是
A.红色铁锈的主要成分是Fe(OH)3
B.钢材在空气中的反应只有氧化反应、还原反应及化合反应
C.钢材在空气中的腐蚀主要为电化学腐蚀,其负极的反应为:Fe-3e-=Fe3+
D.空气中阳光、雨水、湿度对钢材的腐蚀有较大影响
参考答案:D
本题解析:A项,红色铁锈的主要成分是Fe3O4,;B项,钢铁在空气中生锈过程中会有Fe(OH)3进一步部分脱水形成疏松的Fe2O3·xH2O(x取值是任意正实数,一般不会超过1),属于分解反应;C项,其负极的反应为:Fe-2e-="==" Fe2+;D项正确。
本题难度:简单
2、填空题 某课外活动小组进行电解饱和食盐水的实验(如图)。请同答下列问题。
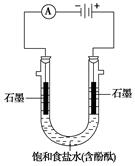
(1)通电一段时间后,可观察到_______________电极(填
“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电
极反应式为____________。
(2)该溶液电解反应的化学方程式为?。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为 ___________________________________。
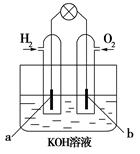
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如下图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。其中a是___极(填“正”或“负”),b极的电极反应式为?。
(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是?(填序号)

A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.燃料电池放电时的正极反应:
H2-2e-+2OH-=2H2O
D.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑
参考答案:(1) 阴极? 2H+ + 2e? → H2↑?
(2) 2NaCl+2H2O Cl2↑+H2↑+2NaOH?
Cl2↑+H2↑+2NaOH?
(3) Fe→Fe2++2e-?(4)负? O2 + 2H2O+ 4e-→4OH-?(5)BC
本题解析:略
本题难度:简单
3、选择题 下列有关物质的性质和该性质的应用均正确的是
[? ]
A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列关于钢铁腐蚀的叙述中正确的是( )
A.吸氧腐蚀时正极放出氧气
B.析氢腐蚀时正极放出氢气
C.化学腐蚀速率超过电化学腐蚀速率
D.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
参考答案:A、吸氧腐蚀正极是氧气得到电子生成氢氧根离子,电极反应为:O2+2H2O+4e-=4OH-,故A错误;
B、析氢腐蚀正极是氢离子得到电子生成氢气,电极反应为2H++2e-=H2↑,故B正确;
C、如果没有形成原电池,在金属变成金属离子溶进水中和水中的氢离子变成氢气,是在同一个地方发生的,这样金属离子在水中扩散时,会和氢离子发生碰撞,阻碍氢离子和金属单质的接触,所以化学反应速率较慢.如果形成了原电池,金属离子在负极上扩散到溶液中,而氢离子在正极上变成氢气,不会被阻碍,所以化学反应速率较快,故C错误;
D、在入海口的钢铁闸门上装一定数量的铜块,铁和铜在海水中形成原电池反应,铁做负极被氧化,发生电化腐蚀,故D错误;
故选B.
本题解析:
本题难度:简单
5、选择题 在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向。如果电动汽车上使用新型钒电池,一次性充电3—5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的1/25和1/10。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:
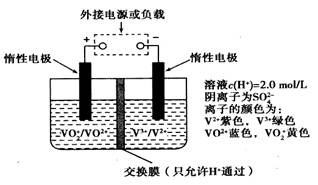
下列有关该钒电池的说法不正确的是:
A.该电池为可逆电池, 当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高
B.放电过程中,右槽溶液中溶液颜色由紫色变为绿色
C.充电过程中, H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应
D.充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)增加了0.5mol
1023个,左槽溶液中n(H+)增加了0.5mol
参考答案:A
本题解析:A、根据装置图可知,当左槽溶液逐渐由黄变蓝,即VO2+转化为VO2+,V元素的化合价从+5价降低到+4价,此时该极上发生得电子的还原反应,其电极反应式为VO2++2H++e-=VO2++H2O,但该该过程是放电过程,故A不正确;B、放电过程中右槽是负极失去电子发生氧化反应,电极反应式为V2+-e-=V3+,所以放电过程中,右槽溶液中溶液颜色由紫色变为绿色,B正确;C、充电过程中右槽发生还原反应,电极反应式为V3++e-=V2+,因此为保持溶液的电中性,充电过程中, H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应,C正确;D、充电时,左槽发生的反应为VO2++H2O-e-=VO2++2H+,当转移电子为3.01×1023个即为0.5mol电子时,生成氢离子为1mol,此时氢离子参与正极反应,通过交换膜定向移动使电流通过溶液,溶液中离子的定向移动可形成电流,通过0.5mol电子,则左槽溶液中n(H+)的变化量为1mol-0.5mol=0.5mol,故D正确,答案选A。
本题难度:一般