| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《常见的化学电源》考点预测(2019年强化版)(十)
参考答案:B 本题解析:将放电时的两个电极反应相加可得:Pb+PbO2+2H2SO4 本题难度:一般 2、选择题 燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质溶液通常是KOH溶液.下列关于甲烷燃料电池的说法错误的是( ) 参考答案:A、燃料在负极上失电子发生氧化反应,甲烷燃烧能生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾,所以电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故A正确; 本题解析: 本题难度:简单 3、选择题 科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是 |
参考答案:C
本题解析:A.该电池的本质是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2 + 6e- + 8H+=2NH4+,正确;B.反应过程中,H+不断消耗导致PH值变大,需要加入盐酸,正确;C.该装置是原电池装置,电流由正极通过外电路流向负极,即由通入氮气的电极沿外电路流向通入氢气的电极,错误;D.通入氢气的电极为负极,生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl,正确;选C。
考点:考查新型燃料电池的工作原理。
本题难度:一般
4、填空题 甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:①CH4 (g) + H2O (g)= CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3="+165.0" kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为 (填序号),其原因是 。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
① 0<V≤44.8 L时,电池总反应方程式为 ;
② 44.8 L<V≤89.6 L时,负极电极反应为 ;
③ V="67.2" L时,溶液中离子浓度大小关系为 。
参考答案:(14分)(1)CH4 (g)+CO2 (g)=2CO (g)+2H2 (g) △H="+247.4" kJ·mol-1(2分)
(2)②(2分) 选择CH4不完全燃烧制合成气时,放出热量,同时得到的CO、H2物质的量之比为1∶2,能恰好完全反应合成甲醇(2分)
(3)低温、高压(2分)
(4)①CH4 +2O2 +2KOH=K2CO3+3H2O(2分)
②CH4—8e-+ 9CO32-+3H2O=10HCO3-(2分)
③c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) (2分)
本题解析:(1)根据盖斯定律,①×2—③可约去H2O(g),则CH4(g)+CO2 (g)=2CO(g)+2H2(g)的△H=①的△H×2—③的△H=[(+206.2)×2—(+165.0)] kJ·mol-1="+247.4" kJ·mol-1;(2)从能量角度比较,①是吸热反应,需要消耗更多能量,②是放热反应,不需要太多能量;从原子利用率角度,由于CO+2H2→CH3OH,①的产物中氢原子不可能全部变为CH3OH,而②的产物中所有原子都可能全部变为CH3OH;因此选②,甲烷不完全燃烧制合成气时放出热量,还得到物质的量之比为1∶2的CO和H2的混合气体,能恰好完全反应生成甲醇;(3)由于正反应是气态物质体积减小的放热反应,因此采用降低温度、增大压强能使平衡右移,提高CO的转化率,防止催化剂中毒;(4)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O =2KHCO3;当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,负极反应式为CH4—8e—+10OH—=CO32—+7H2O;当44.8 L<V≤89.6 L,2mol <n(CH4)≤4mol,则2mol <n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4—8e—+ 9CO32—+3H2O =10HCO3—;当V="67.2" L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1mol K2CO3和2mol KHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
考点:考查化学反应运力,涉及运用盖斯定律计算焓变、热化学方程式的书写、评价物质合成方案、影响化学平衡的因素、燃料电池、溶液中离子浓度大小关系等重要考点。
本题难度:一般
5、填空题 (8分)下图是氨氧燃料电池示意图,按照此图的提示,回答下列问题: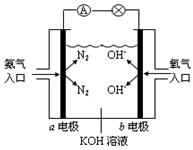
(1)a电极作______极(填“正”、“负”或“阴”、“阳”),其电极反应式为_________________;
(2)反应一段时间后,电解质溶液的PH将?(填“增大”、“减小”或“不变”);
(3)已知N2(g)+3H2(g)=2NH3(g) ΔH=" —92.4" kJ·mol-1;2H2(g)+O2(g)=2H2O(g) ΔH=" —483.6" kJ·mol-1,试写出氨气完全 燃烧生成气态水的热化学方程式:__________________________;
燃烧生成气态水的热化学方程式:__________________________;
(4)若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上97.5g锌,理论上至少需要消耗氨气_________L(标准状况)。
参考答案:(8分)
(1)负(1分)? 2NH3-6e-+6OH-=N2+6H2O(2分,见错无分)
(2)减小(1分)
(3) 4NH3(g)+3O2(g) = 2N2(g) +6H2O(g) ΔH=" —1266" kJ·mol-1(2分,见错无分)
(4)22.4(2分)
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《有机物的命.. | |