1、选择题 普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3+H2.根据以上所述判断下列结论不正确的是( )
A.工作时Zn为负极,发生还原反应
B.工作时电流由碳极经外电路流向Zn极
C.输出电流时碳棒上发生还原反应
D.长时间使用后内装糊状物可能流出,腐蚀用电器
参考答案:A.锌失电子而作负极,负极上发生氧化反应,故A错误;
B.干电池工作时,电流从正极碳经外电路流向负极锌,故B正确;
C.放电时,正极上得电子发生还原反应,故C正确;
D.NH4Cl和ZnCl2都是强酸弱碱盐水解呈酸性,所以干电池长时间连续使用时内装糊状物可能流出腐蚀电器,故D正确;
故选A.
本题解析:
本题难度:一般
2、填空题 (1)今有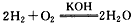 反应,构成燃料电池,则负极通入的应是_________,正极通入的应是
反应,构成燃料电池,则负极通入的应是_________,正极通入的应是
_______, 电极反应式为_____________;_____________。
(2)如把KOH改为稀H2SO4做电解质,则电极反应式为_____________;_____________。(1)和(2)的电池液不同,反应进行后,其溶液的pH各有何变化?______________________。
(3)如把H2改为甲烷,KOH做导电物质,则电极反应为_________________;_________________。
参考答案:(l)H2;O2;负极:2H2+4OH--4e-=4H2O;正极:O2+2H2O+4e-=4OH-
(2)负极:2H2-4e-=4H+;正极:O2+4H++4e-=2H2O;先变小,后变大
(3)负极:CH4+10OH--8e-=CO32-+7H2O;正极:2O2+4H2O+8e-=8OH-
本题解析:
本题难度:一般
3、选择题 能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是( )
A.用铜片作阴、阳极,电解氯化铜溶液
B.用铜片作阴、阳极,电解硫酸钾溶液
C.铜锌合金在潮湿空气中发生电化学腐蚀
D.铜片和碳棒用导线相连后同时插入一烧杯内的氯化钠溶液中
参考答案:金属铜和水之间发生的反应是非自发的氧化还原反应,应设计成电解池,在反应Cu+2H2O═Cu(OH)2↓+H2↑中,失电子的是金属铜,所以必须选择金属铜作阳极材料,其他导电的物质做阴极材料即可,在阴极上应该是水中的氢离子得电子的反应,可以选择硫酸钠等来做电解质.
A、用铜片作阴、阳电极,电解氯化铜溶液,阳极失电子生成铜离子,阴极铜离子得到电子析出铜,故A错误;
B、用铜片作阴、阳电极,电解硫酸钾溶液,可以实现该反应的发生,故B正确;
C、铜锌合金在潮湿的空气中发生电化学腐蚀时,金属锌被腐蚀,铜被保护,故C错误;
D、原电池原理不能实现该非自发的氧化还原反应,故D错误;
故选B.
本题解析:
本题难度:一般
4、填空题 已知甲池的总反应式为: 2CH3OH+3O2+4KOH?2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。

甲池是?装置;乙池是?装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是?,B(石墨)电极的名称是?。
(3)写出电极反应式:通入O2的电极的电极反应式是?。
(4)乙池中反应的化学方程式为?。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O?2?mL(标准状况下)
参考答案:(1)原电池(化学能转变为电能)?电解池(电能转变为化学能)
(2)负极?阳极
(3)O2+2H2O+4e-=4OH-
(4)4AgNO4+2H2O=4Ag+O2↑+4HNO3
(5)280
本题解析:(1)由装置图可以看出甲池为原电池,乙池是电解池。(2)通入燃料CH3OH的电极名称是负极,通入氧气的电极为正极。在乙池中与电源的正极相连接的石墨电极B为阳极。与电源的负极相链接的Fe电极为阴极。(3)在原电池中,负极发生氧化反应。正极上发生还原反应。由于是碱性环境,所以在通入O2的电极即正极的电极反应式是O2+2H2O+4e-=4OH-。(5)由于在整个闭合回路中电子转移的数目相等。所以当乙池中A(Fe)极的质量增加5.40g时,n(Ag)=n(e-)=5.40g÷107g/mol=0.05mol.则n(O2)= 0.05mol÷4=0.0125mol.所以V(O2)= 0.0125mol×22.4L/mol=0.28L=280ml。
本题难度:一般
5、选择题 将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是
[? ]
A.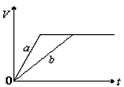
B.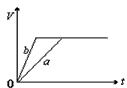
C.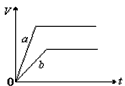
D.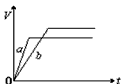
参考答案:D
本题解析:
本题难度:一般