1、选择题 下列结论不正确的是
A粒子半径:S>S2->Cl-
B氢化物沸点:H2O>HF>HCl
C结合质子能力:OH->SiO>CO
D离子还原性:S2->I->Br-
参考答案:A
本题解析:粒子半径S小于它的离子,A错;O、F元素的电负性较强,对应的氢化物含有氢键,由于水中氢键数目较多,且氢键作用力原大于分子间作用力,则有氢化物沸点:H2O>HF>HCl,B正确;水显中性、酸性硅酸小于碳酸,因而结合质子能力C选项正确;非金属性越强,其阴离子的还原性越弱,D正确。
本题难度:一般
2、选择题 短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是
A.原子半径A<B<C ?B.A的氢化物的稳定性大于C的氢化物的稳定性
C.C的氧化物的熔点比A的氧化物的低? D.A与C可形成离子化合物
参考答案:B
本题解析:根据题意可得A是C;B是Mg;C是Si。A.原子核外的电子层数越多,原子半径就越大。当原子核外电子层数相同时,原子序数越大,原子半径就越小。因此原子半径:Mg> Si >C。错误。B.元素的非金属性越强,其氢化物的稳定性就越强。元素的非金属性C>Si,所以稳定性CH4>SiH4。C.C的氧化物SiO2是原子晶体,原子间通过共用电子对结合,结合力强,断裂难,素养熔点高,而A的氧化物CO2属于分子晶体,分子之间通过分子间作用力结合,分子间作用力是一种很弱的作用力,所以破坏溶液,因此熔点低,在室温下CO2是气体。错误。D.A与C可形成的化合物SiC是共价化合物。错误 。
本题难度:一般
3、填空题 (14分)已知A、B、C、D、E、F是短周期中的6种非金属元素,它们的原子序数依次增大。A元素是周期表中半径最小的元素, B原子的最外层上有4个电子;C与D在周期表中处于相邻的位置,D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体Y;F的L层电子数等于K、M两个电子层上电子数之和
(1)请写出元素符号:
A?B?C?D?E? F??
(2)画出F的阴离子的结构示意图?
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为?
向X的水溶液中滴入酚酞溶液,会观察到?
(4)写出E在D的单质中点燃,生成固体Y化学方程式?
(5)将12gB单质在足量的D单质中燃烧,所得气体通入1L? 1mol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是?。(相对原子质量:C—12)
参考答案:

本题解析:略
本题难度:简单
4、选择题 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
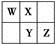
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
参考答案:A
本题解析:根据W的气态氢化物可与其最高价含氧酸反应生成离子化合物,则推出W应为N,所以X为O、Y为S、Z为Cl。A项,H2O、H2S、HCl中稳定性最弱的是H2S,正确。B项,Cl的氧化物对应的水化物有HClO、HClO2、HClO3、HClO4,S的氧化物对应的水化物有H2SO3、H2SO4,错误。C项,O2-的还原性小于S2-的还原性,错误。D项,Cl2在化学反应中既可以表现氧化性,又可以表现还原性,如Cl2和NaOH的反应,错误。
本题难度:一般
5、选择题 根据主族元素的原子序数能确定的是:(?)
A.质子数
B.中子数
C.价电子数
D.相对原子质量
参考答案:A
本题解析:原子序数=核电荷数=质子数=核外电子数,由原子序数可以确定质子数和价电子数,中子数由质量数和质子数确定,元素的相对原子质量相当于质量数,由质子数与中子数确定,故本题应选A。
点评:本题主要考查原子序数与元素原子结构之间的关系,题目难度不大。
本题难度:简单