| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学反应与能量》典型例题(六)
参考答案:D 本题解析:反应中生成物总能量高于反应物总能量的反应为吸热反应,所以 本题难度:一般 3、选择题 一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为 参考答案:B 本题解析:根据反应速率之比是相应的化学计量数之比可知,氨气的反应速率是0.3mol/(L·s),所以生成氨气是0.3mol/(L·s)×2s=0.60mol/L,答案选B。 本题难度:简单 4、选择题 下列说法正确的是 |
参考答案:C
本题解析:A.热化学方程式中,化学式前面的化学计量数只表示物质的量,错误;B.热化学方程式中,如果没有注明温度和压强,则表示在通常状况下测得的数据,错误;C.由于物质的能量与物质的多少、聚集状态等有关,所以书写热化学方程式时,不仅要写明反应热的符号、数值和单位,还要注明各物质的聚集状态,正确;D.大多数化合反应是放热反应,分解反应是吸热反应,但是也有例外,如氢气与碘蒸气产生HI的化合反应是吸热反应;KClO3分解产生KCl和O2的反应是分解反应,也是放热反应,错误。
考点:考查化学反应和化学方程式的书写应该注意的问题的知识。
本题难度:一般
5、填空题 氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。
(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是 。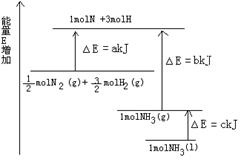
(2)已知:①H2O(g)=H2O(l) ΔH=-Q1 kJ·mol-1
②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q2 kJ/mol ③C2H5OH(g)=C2H5OH(l) ΔH=-Q3 kJ/mol
则23 g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为 kJ(请用Q1、Q2、Q3来表示 )
参考答案:(1)N2(g) +3H2(g)  2NH3(l) △H=" -2(b+c-a)" kJ/mol(2)(0.5Q2+1.5Q1-Q3)
2NH3(l) △H=" -2(b+c-a)" kJ/mol(2)(0.5Q2+1.5Q1-Q3)
本题解析:(1)根据图示可知:由反应物的能量与生成物的能量的关系可知N2与H2反应生成液态氨的热化学方程式是N2(g) +3H2(g)  2NH3(l) △H=" -2(b+c-a)" kJ/mol。(2)②-③+3×①整理可得C2H5OH(g)+ 3O2(g)=2CO2(g)+3H2O(l) △H=-(Q2+3Q1-Q3) kJ/mol。1mol的乙醇质量为46g.所以23 g液体酒精即0.5mol完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q2+1.5Q1-Q3)KJ.
2NH3(l) △H=" -2(b+c-a)" kJ/mol。(2)②-③+3×①整理可得C2H5OH(g)+ 3O2(g)=2CO2(g)+3H2O(l) △H=-(Q2+3Q1-Q3) kJ/mol。1mol的乙醇质量为46g.所以23 g液体酒精即0.5mol完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q2+1.5Q1-Q3)KJ.
考点:考查热化学方程式的书写及反应热的计算的知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《化学平衡状.. | |